Insuffisance rénale chronique et maladies rénales chroniques

INTRODUCTION/GÉNÉRALITÉ
- L’insuffisance rénale chronique (IRC) est définie par la diminution irréversible du débit de filtration glomérulaire (DFG) qui est le meilleur indicateur du fonctionnement rénal. Elle résulte de l’évolution d’une maladie rénale chronique (MRC), soit de la non-récupération après une agression rénale aiguë.
Conformément à un consensus international, les MRC sont définies par l’existence depuis plus de 3 mois :
- d’une insuffisance rénale définie par un débit de filtration glomérulaire (DFG) inférieur à 60 ml/min/1,73 m2,
- et/ou d’une anomalie rénale morphologique ou histologique à condition qu’elle soit « cliniquement significative »,
- et/ou d’une anomalie dans la composition du sang ou de l’urine secondaire à une atteinte rénale.
- Le problème crucial, chez les patients atteints d’IRC, est de déterminer s’il s’agit d’une réduction physiologique liée à l’âge, non ou peu évolutive, ou d’une maladie rénale évolutive exposant au risque de progression vers l’insuffisance rénale terminale (IRT) et au décès, imposant la mise en œuvre rapide d’une stratégie de néphroprotection.
- Chez la plupart des patients en France, l’IRT peut être traitée par la transplantation rénale et/ou l’épuration extrarénale (hémodialyse ou dialyse péritonéale).
- La Maladie Rénale Chronique (MRC) est un problème de santé publique.
- Le nombre de patients atteints de MRC va s’accroitre en raison du vieillissement de la population.
- Sa prise en charge représente un véritable enjeu pour les années à venir que ce soit sur le plan médical, socio économique ou éthique.
- Il est essentiel de connaître les recommandations pour permettre de :
- Diminuer la morbi-mortalité cardiovasculaire particulièrement élevée de la MRC.
- Limiter le nombre de patients arrivant en insuffisance rénale avancée voire en dialyse
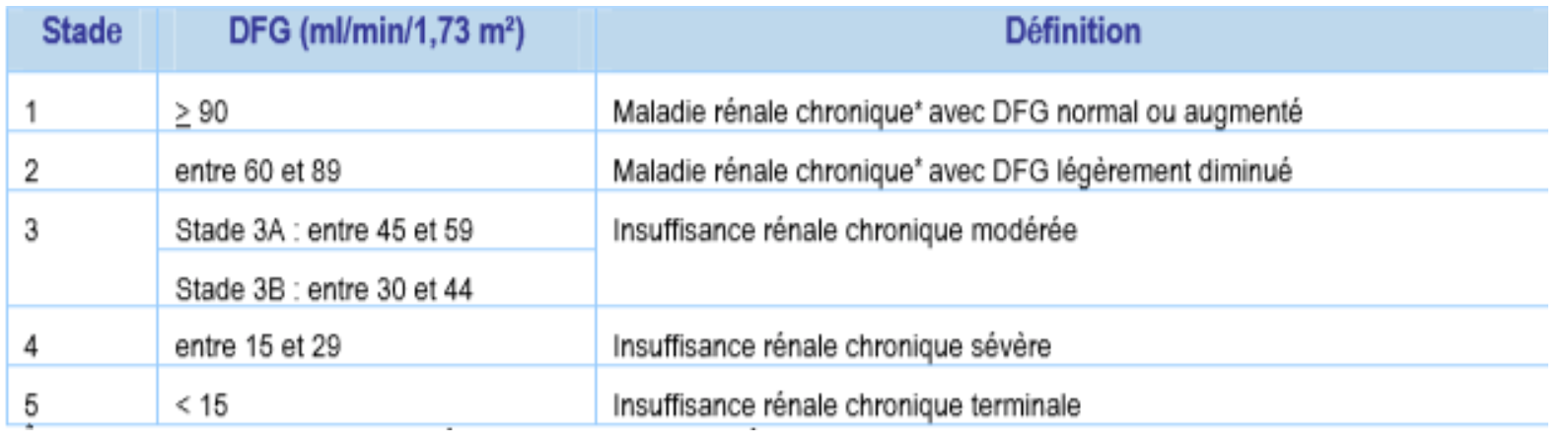
- La maladie rénale chronique (MRC) est définie indépendamment de sa cause, par la présence, pendant plus de 3 mois, de marqueurs d’atteinte rénale ou d’une baisse du débit de filtration glomérulaire estimé (DFG estimé) au-dessous de 60 ml/min/1,73 m².
La Subdivision du stade 3 en deux groupes à été réalisée à la suite d’études ayant montré que ces 2 populations de patients avait un profil de risque et de pronostique différents, population très hétérogène.
Le risque de décès, d’évènement cardio vasculaire et le taux d’hospitalisation étant plus important au stade 3 B. Soit pour un DFG<45 ml/min/1,73 m²
La MRC est donc une diminution du fonctionnement des reins qui ne filtrent plus correctement le sang, quelque en soit la cause. On parle d’Insuffisance Rénale à partir du stade 3 , DFG <60 ml/min/1,73 m²
L’IRC fait partie de la MRC
La maladie est longtemps silencieuse, d’évolution progressive et sans possibilité de guérison
DÉFINITION
Elle est en rapport avec un sur risque cardio vasculaire : la maladie rénale chronique (y compris la protéinurie isolée) met le patient à haut risque cardio-vasculaire, indépendamment des FRCV classiques.
L’enjeu est une prise en charge globale qui consiste en une recherche du diagnostic étiologique, une réduction de la vitesse de progression et un traitement des complications.
L’IRC est dite terminale pour un DFG<15 ml/min/1,73 m²
HISTORIQUE
Votre texte ici
PHYSIOPATHOLOGIE
Votre texte ici
ÉPIDÉMIOLOGIE
- Le nombre total de malades souffrant d’insuffisance rénale est difficile à évaluer car la maladie ne se manifeste que lorsqu’elle a atteint un stade très avancé, parfois au bout de plusieurs dizaines d’années d’évolution silencieuse. Elle reste asymptomatique pendant des années et n’a de manifestations cliniques qu’à un stade avancé.
- Les études épidémiologiques disponibles en population générale évaluent à : 10 % la prévalence des adultes ayant une maladie rénale chronique en France, soit près de 3 millions de personnes. Une partie va évoluer vers une maladie rénale nécessitant un traitement de suppléance (dialyse ou greffe).
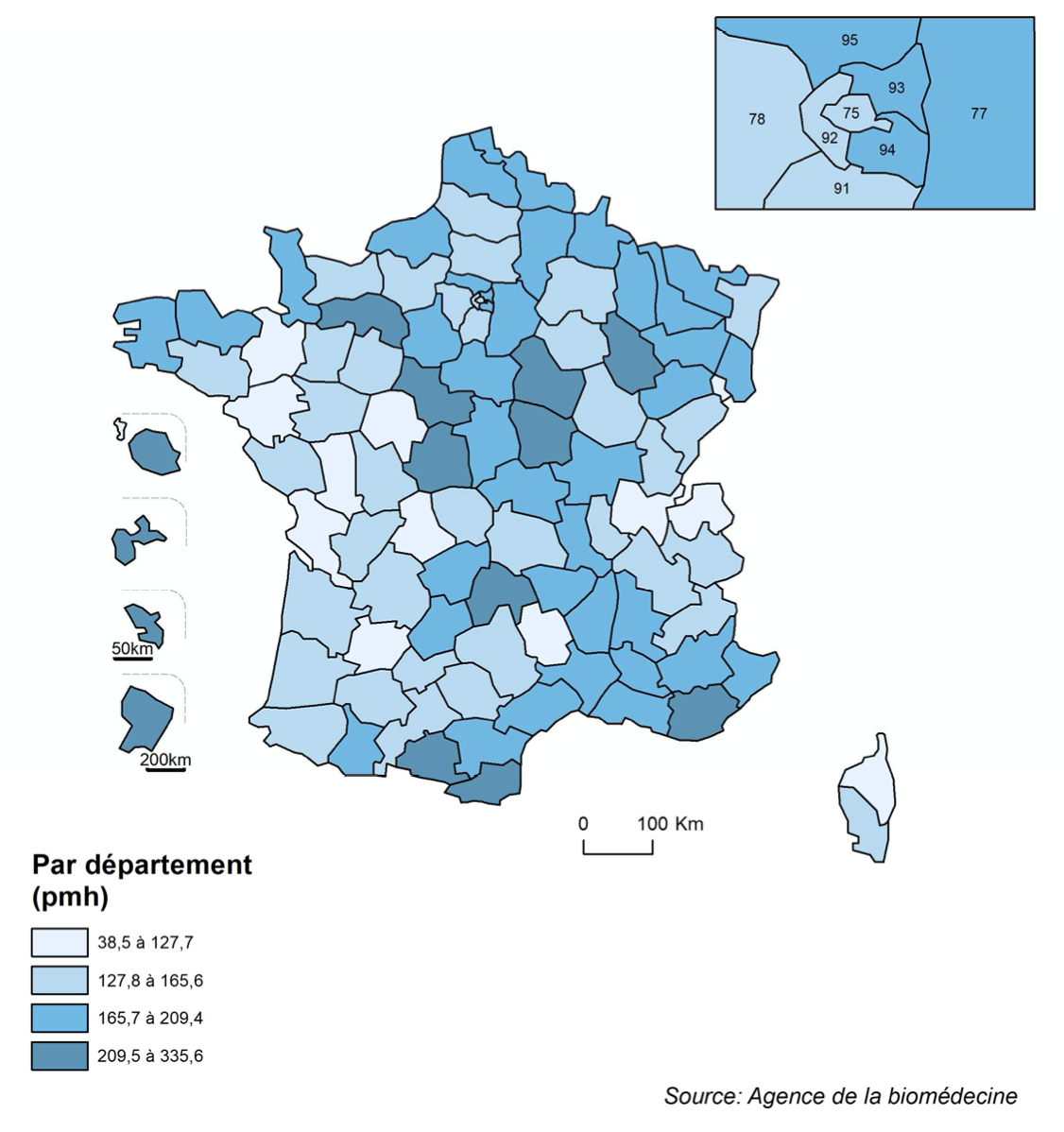
- Incidence et prévalence de la maladie rénale chronique au stade de la dialyse et de la greffe en 2018 : En 2018, 11 343 personnes ont commencé un traitement de suppléance pour insuffisance rénale chronique terminale (IRT) en France, soit une incidence globale de 168 par million d’habitants (pmh) : 10 879 ont débuté par la dialyse (161 pmh) et 464 par une greffe rénale préemptive, sans dialyse auparavant (7 pmh). L’incidence standardisée sur l’âge et le sexe est presque 2 fois plus élevée dans les départements d’outre-mer que dans l’hexagone, 296 versus 165 pmh. Ce taux d’incidence, après avoir connu une première baisse en 2016, puis une hausse en 2017, redescend en 2018 au niveau de 2013. En 2018, l’âge médian des patients à l’initiation du traitement est de 70,4 ans pour l’ensemble des régions. Les néphropathies hypertensive et vasculaire (26 %) et la néphropathie diabétique (22 %) représentent près de la moitié des cas. 1 1
Tendances de l’incidence de la maladie rénale chronique traitée par suppléance : Entre 2012 et 2018, l'incidence globale standardisée de la maladie rénale chronique traitée par suppléance a augmenté de 0,5 % par an passant de 164 par million d’habitants (pmh) à 168 pmh.
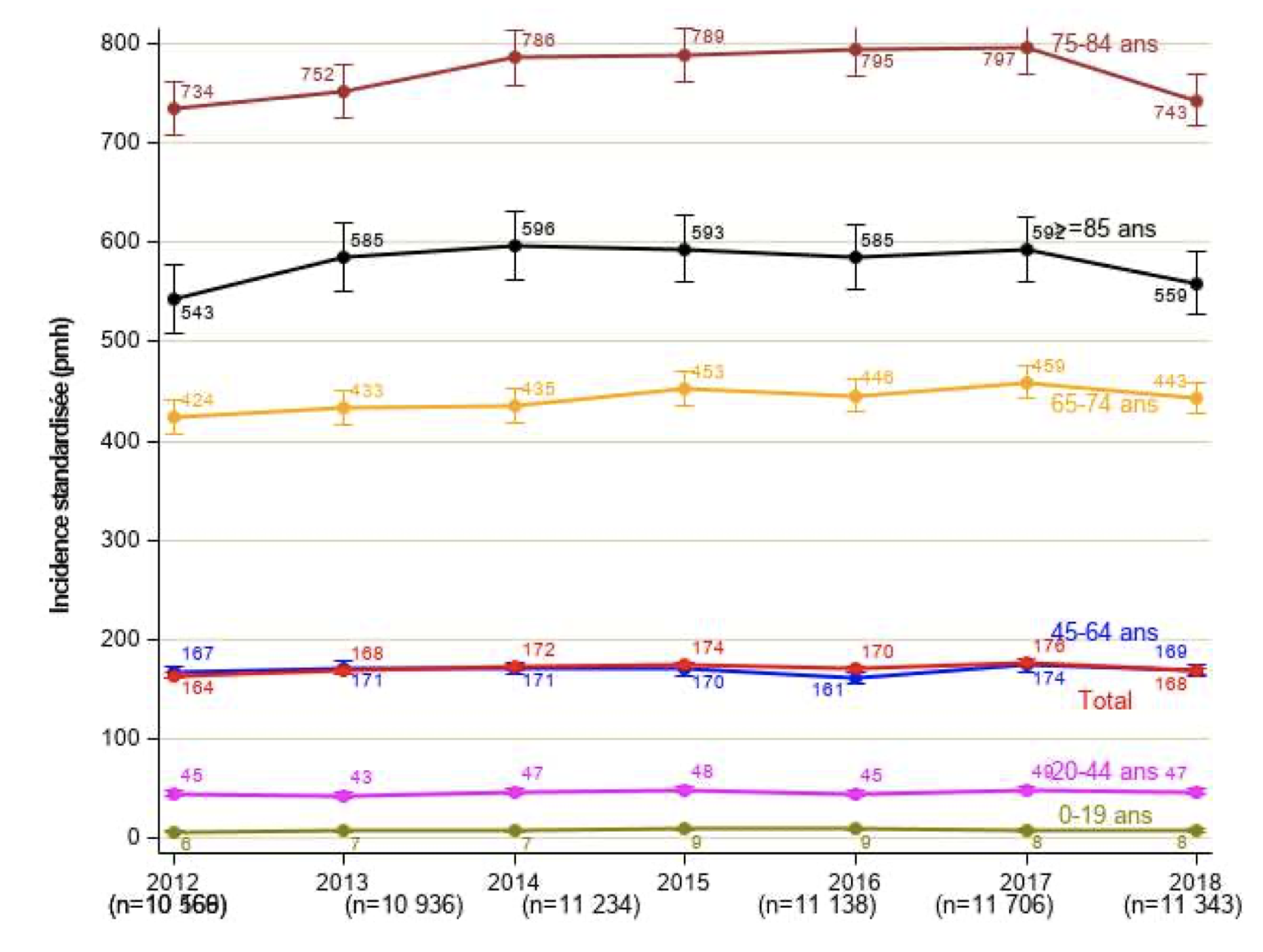
(taux standardisés sur la population française au 30/06/2018, par million d’habitants)
L'épidémiologie de l'insuffisance rénale terminale au sens strict telle qu'elle est définie par le stade 5 de la classification de la HAS est inconnue.
En effet, les données des patients prévalent et l’incidence des patients recevant un traitement de suppléance rénale sont plus exhaustives grâce à l'existence du registre national « Réseau Epidémiologique et Information en Néphrologie (REIN) » mis en place en 2002, alors que celles des personnes atteignant le stade terminal mais qui ne sont ni dialysées ni greffées reste méconnue.
Le réseau REIN recueille chaque année des informations sur l’ensemble des patients traités en France par dialyse ou greffe, dans le but d’estimer les besoins de la population et de contribuer à élaborer les stratégies sanitaires de prévention et de prise en charge de l’insuffisance rénale chronique.
Les données du réseau REIN de 2017 (cf site)
Le nombre de patients en suppléance est supérieur à la moyenne nationale dans certains départements comme le nord-est, le sud, l’est de l’Ile de France et dans les territoires d’outre-mer.
C’est beaucoup plus, exemple : durant l’année 2017 : 3 245 patients dialysés ont reçu une greffe rénale
Plusieurs explications sont possibles telles que la fréquence du diabète et de l’hypertension ou de facteurs génétiques dans ces départements.
L’augmentation du nombre de patients en traitement de suppléance est régulière et constante, environ +4% chaque année.
La MRC se manifeste rarement avant 45 ans, et sa prévalence augmente avec l’âge, notamment après 65 ans.
Les patients qui démarrent un traitement par dialyse sont souvent âgés avec plusieurs maladies associées en plus de leur maladie rénale. Ces patients nécessitent une prise en charge globale pluridisciplinaire la plus précoce possible.
1 patient sur 5 n’a pas vu de néphrologue avant le début de la dialyse
1 sur 3 a débuté la dialyse en urgence
1 sur 2 a débuté la dialyse avec un cathéter
Ces chiffres laissent penser que l’on pourrait améliorer la prise en charge en amont des patients par le dépistage, la sensibilisation, la prévention, l’information et l’organisation du parcours de soins.
Ce démarrage de la dialyse en urgence est problématique pour certains patients. Il induit en effet un choc psychologique et a un fort impact sur la qualité de vie du patient tant au niveau familial qu’au niveau professionnel.
La MRC est en augmentation constante avec le vieillissement de la population en France
10 % de la population concernée
Les 2 principales causes sont l’HTA et le diabète
Place primordiale du Médecin généraliste pour identifier les cas, ralentir la maladie et orienter les patients
FACTEURS DE RISQUES
FACTEURS ETIOLOGIQUES
Dans 50% des cas, les maladies rénales chroniques qui conduisent à l’insuffisance rénale sont la conséquence d’un diabète ou d’une hypertension artérielle.
Les autres néphropathies peuvent impliquer différents mécanismes, inflammatoire, dégénératif ou génétique.
Les glomérulonéphrites primitives, qui constituaient la majeure partie des insuffisances rénales dans les années 1990, ne concernent plus que 12% des patients, mais elles doivent être diagnostiquées précisément car elles répondent souvent à un traitement spécifique.
Les pyélonéphrites constituent 4,3% des nouveaux cas d’insuffisance rénale. L’ infection répétée des voies urinaires hautes, souvent par E. coli, affectant l’un ou les deux reins peut conduire à une MRC.
L’insuffisance rénale peut également résulter d’une maladie génétique héréditaire affectant les reins : La polykystose est la plus fréquente d’entre elles avec 1 personne sur 1 000 touchée, ce qui représente 800 000 personnes en France et 5,4% des nouveaux cas répertoriés en 2015.
Elle se manifeste par l’apparition progressive de kystes le long du tubule qui récupère les déchets filtrés par le glomérule. En proliférant et en grossissant, ces kystes envahissent les reins et empêchent leur fonctionnement normal.
EXAMEN CLINIQUE
- En France , la classification de la MRC a été établie en 5 stades de sévérité croissante à partir du Débit de Filtration Glomérulaire (DFG)
-
Un Débit de Filtration Glomérulaire <60 ml/min/1,73 m² correspond à une Insuffisance Rénale
-
ainsi que de la présence de marqueurs d’atteinte rénale.
-
Albuminurie >30mg/24h ou un rapport albuminurie/créatininurie > 2 mg/mmol
-
Hématurie : GR > 10/mm3 ou 10 000/ml (après avoir éliminé une cause urologique)
-
Leucocyturie : GB >10/mm3 ou 10 000/ml (en l’absence d’infection)
-
Anomalies morphologiques rénales (en échographie) : asymétrie de taille, contours bosselés, rein de petite taille ou gros reins polykystiques, néphrocalcinose, kyste.
-
-
Ces marqueurs sont considérés comme positifs s’ils persistent plus de 3 mois
On parle de Maladie Rénale Chronique (sans IRC) pour un DFG>60 si on retrouve un marqueur d’atteinte rénale
Le stade de la MRC conditionne les modalités de prise en charge thérapeutique
EXAMENS COMPLÉMENTAIRES
Votre texte ici
IDENTIFICATION DES SITUATIONS D’URGENCES
- glomérulonéphrite rapidement progressive (dégradation rapide de la fonction rénale : syndrome glomérulaire, signes extra-rénaux),
- insuffisance rénale aiguë (éliminer un obstacle)
- Troubles ioniques menaçant (hyperkaliémie > 6 mmol/l ou acidose avec bicarbonatémie < 10 mmol/l)
-Une hématurie
-Une albuminurie
-Et souvent une hypertension artérielle
ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
Votre texte ici
PRISE EN CHARGE THÉRAPEUTIQUE
A) Maitrise des FDR CV
Les objectifs généraux du traitement de la MRC sont :
- Traiter la maladie causale
- Ralentir la progression de la maladie rénale
- Prévenir le risque cardio-vasculaire
- Prévenir les complications de la MRC
- Il n’y a pas d’objectif curatif
Les 2 facteurs de progression majeurs des maladies rénale chronique sont l'hypertension artérielle systémique et la protéinurie. Le ralentissement de la progression de la MRC passe par un contrôle des FRCV, étant donné qu’ils favorisent l’HTA et la Protéinurie.
La Maitrise des FDR CV est d’autant plus importante que la MRC est déjà en soit un Facteur de Risque Cardio Vasculaire du fait de l’urémie (toxines urémiques cardio toxiques, défaut de capacité de vasodilatation) et du risque de calcification vasculaire.
Un patient avec une MRC est donc considéré comme à «haut risque cardiovasculaire » dès le stade 3 et indépendamment des autres FRCV classiques.
Les cibles thérapeutiques permettant de préserver la fonction rénale ont pour objectifs :
- TA : Cf objectifs vu précédemment
- Protéinurie < 0,5 g/jour
- LDL < 1 g/l au stade 3,
- LDL<0.7 à partir du stade 4 chez le patient non dialysé
- HbA1C <7 – 8 %
- Activité physique régulière
- Poids dans la norme
- Pas d’intoxication tabagique
1) Contrôle des lipides
- Les mesures de prévention du risque cardio-vasculaire des patients ayant une MRC sont identiques à celles de la population à risque élevé sans MRC (le risque cardio-vasculaire des patients avec MRC étant élevé). Il convient donc d’appliquer les recommandations définies pour le traitement des dyslipidémies de la population à risque élevé.
- En conséquence, en complément des mesures hygiéno-diététiques, la prescription de statine est justifiée en cas de dyslipidémie.
- L’objectif de traitement est un LDL < 1 g/l au stade 3, LDL<0.7 à partir du stade 4 chez le patient non dialysé
- Les statines doivent être utilisées en cas d’insuffisance rénale chronique, avec les précautions d’usage : surveillance de la toxicité musculaire.
- Les fibrates sont de manière générale contre indiqués au cours de l’insuffisance rénale chronique avec un débit de filtration glomérulaire < 30 ml/min, leur introduction nécessite un avis spécialisé.
- Le traitement par statine n’est pas recommandé en cas de traitement par dialyse (pas de preuve de son efficacité).
2) Contrôle glycémique
- L’HbA1c est souvent perturbée en cas d’IRC
- faussement élevée en cas d’acidose,
- faussement diminuée en cas d’hémolyse ou de carence martiale.
- Le risque hypoglycémique est plus élevé à partir du stade 3 du fait de la diminution de la clairance de l’insuline et des antidiabétiques oraux, et de la réduction de la glucogenèse rénale.
- En conséquence, l’HAS en 2013 recommande une cible d’HBA1c :
inférieure ou égale à 7 % en cas d’insuffisance rénale chronique modérée
(Stade 3)
et
inférieure ou égale à 8% en cas d’insuffisance rénale sévère ( Stade 4 et 5).
3) Maitrise du poids et lutte contre la sédentarité
- Pour les adultes pratiquer par semaine pour lutter contre la sédentarité:
- au moins 2h30 d’une activité physique d’intensité modérée,
- Ou au moins 75 minutes d’une activité physique intense,
- Ou une combinaison équivalente d’activité physique d’intensité modérée à forte.
- Pour retirer des bienfaits supplémentaires en matière de santé, les adultes devraient porter à 300 minutes ( 5h) par semaine la pratique d’une activité physique d’intensité modérée ou l’équivalent ;
- Inclure des activités de renforcement musculaire mettant en jeu les principaux groupes de muscles devraient être pratiquées deux jours par semaine ou plus.
4) Arrêt du tabac
- Outre ses effets cardiovasculaires, le tabac favorise la progression de la maladie rénale chronique.
- Arrêt impératif chez tout patient ayant une maladie rénale chronique
B) Conseils diététiques
L’enjeu la nutrition du patient est d’assurer un état nutritionnel optimal pour :
- Lutter contre l’obésité
- Eviter les anomalies hydro-électrolytiques
- Ralentir la progression de la MRC
- Contrôler les symptômes de l’urémie
- Eviter la dénutrition (perte de la masse musculaire)
- La Dénutrition est un vrai problème dans les stades avancés de la maladie rénale chronique.
- Nécessité d’une évaluation utilisant les données anthropométriques (Poids et son évolution, taille et Index de masse corporelle) et biologiques (albuminémie + CRP).
- Possibilité d’utiliser les compléments nutritionnels à tous les stades de la maladie rénale chronique.
a) Adopter une alimentation alcalinisante
- Pour éviter l’acidose chronique.
- En limitant la charge acide de l’alimentation, on peut ralentir le déclin de la fonction rénale.
- De manière générale, la viande, les fromages, les œufs, les céréales sont plutôt des aliments acidifiants, tandis que les fruits et légumes sont plutôt alcalinisants.
- Il faudrait deux fois plus d’aliments alcalinisants dans l’assiette que d’aliments acidfiants, ce qu’on réalise en suivant un régime alimentaire centré sur les végétaux (attention toutefois à l’excès éventuel de potassium).
- Objectif : Avoir une bicarbonatémie >22 mmol/l
- Pourquoi : perte musculaire (catabolisme protéique excessif)
b) Limiter ses apports en protéines
- il est conseillé de limiter ses apports protéiques .
- Un régime enrichi en protéines entraine une hyper filtration glomérulaire.
- Plus l’apport protéique est bas, plus la maladie progresse lentement.
- Cependant il est dangereux d’aller en-dessous de 0,6 g/kg/jour (risque de dénutrition)
- Il est recommandé de consommer 0,8 g/kg/jour de protéines. Soit 50 g pour les femmes et de 60 g pour les hommes sauf en cas de dialyse ou il est conseillé un régime hyperprotéique (>1,2g/kg/j ).
c) Privilégier les protéines végétales plutôt qu’animales
- Les végétaux ont aussi comme avantage d’être alcalinisant, quand les viandes sont plutôt acidifiantes.
- Les légumineuses comme le soja sont une source intéressante de protéines végétales, mais doivent parfois être limitées si les taux de phosphore et de potassium sont élevés.
- Les céréales et les pâtes sont une autre source de protéines interessantes.
d) Réduire les apports en sel
- Une restriction sodée à 100 mmol/j (6 g de NaCl/j) permet une amélioration du contrôle de la pression artérielle chez les patients ayant une MRC.
- Elle peut être diminué à 3 à 4g de Nacl par jour en cas de rétention hydro sodée.
- Attention au sel caché : pain, fromage, conserves, charcuteries, biscuits apéritifs, plats préparés manufacturés …
- La règle doit être de ne pas se resservir en sel à table (assaisonnement des plats avec des herbes et des épices).
- Le suivi peut être vérifié par la mesure de la natriurèse des 24 heures (1 g d’apport de sel correspondant à 17 mmol de Na urinaire).
e) Éviter l’excès de phosphore
- Tendance à l’hyperphosphatémie au cours de l’insuffisance rénale chronique lié à une baisse de l’élimination urinaire du phosphore.
- Le patient doit limiter les sources alimentaires riches en phosphore très disponible comme les abats, les sardines, les légumes secs, la bière, le lait, les fromages, le chocolat.
- Limiter les apports en phosphore (< 800 mg/j)
f) Assurer l’équilibre phosphocalcique
- Tendance à l’hypocalcémie lié à une diminution de production de la vitamine D active
- Objectif : maintenir la calcémie dans les valeurs normales (2,2 mmol/l - 2,6 mmol/l) et la phosphophatémie < 1,5 mmol/l
- Préconisations : Apport en calcium sans excès (1 g/j) et apport en vitamine D si carence
g) Éviter les excès de potassium
- Tendance à l’hyperkaliémie au cours de l’insuffisance rénale chronique liée à une baisse de l’élimination urinaire du potassium.
- L’hyperkaliémie peut de plus être favorisée par la prise de certains médicaments (Inhibiteur de l’enzyme de conversion,…)
- Apport en potassium recommandé à 5 g/j en l’absence d’hyperkaliémie et au stade 1 à 3 de l’insuffisance rénale chronique.
- Limiter les apports à moins de 3 g/j en cas d’hyperkaliémie ou au stade 4 à 5 de l’insuffisance rénale chronique.
- Il est impératif pour le patient d’éviter les fruits et légumes riches en potassium : fruits à « gros noyau » :pêches, prunes et pruneaux, abricots, mangues,…
- mais aussi la banane, le kiwi et les fruits secs…
- Limiter les légumes secs ,l’avocat, les pommes de terre et les patates douce,…
- Cuire en deux fois ou faire tremper permet de réduire la teneur en potassium des aliments de 20-70%.
h) Boire à sa soif
- Ne pas se forcer à boire,
- pas d’effet d’une hydratation abondante sur la fonction rénale
- Boire autour de 1,5 litres d’eau par jour
- En cas d’insuffisance rénale arrivée au stade de la la dialyse, limiter ses apports hydriques
- Entre 2 séances d’hémodialyse, la prise de poids résultant de l’accumulation d’eau dans l’organisme ne doit pas dépasser 5 % du poids du corps :
- Volume de boisons par jour = 250 ml + volume d’urines par 24 heures
- En cas d’anurie, volume de boissons par jour = 750 ml
i) Apport énergétiques adaptés
- Le surpoids, l’obésité , le diabète favorisent l’insuffisance rénale, mais il est possible d’améliorer la fonction rénale et de réduire le risque cardiovasculaire
- en perdant le poids en excès.
- Le besoin énergétique est équivalent à la population générale
- Objectif énergétique : 30 à 40 kcal/kg/j
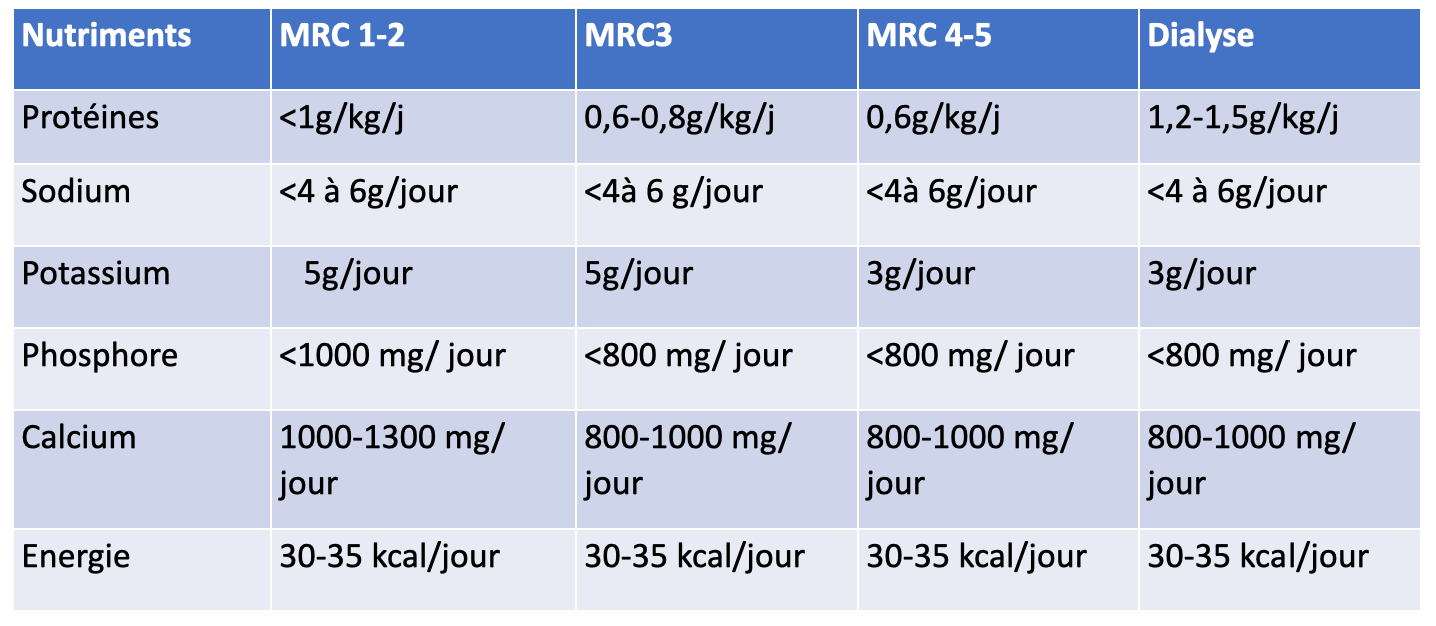
Synthèse sur les apports en nutriments dans la maladie rénale chronique :
C) Education Thérapeutique (ETP)
L’un des axes essentiels du traitement est donc non médicamenteux et touche aux modifications du mode de vie. L’éducation thérapeutique est utile pour atteindre ces objectifs. L’information et une éducation thérapeutique adaptées sont complémentaires des traitements et des soins pour permettre au patient d’acquérir, de maintenir des compétences dont il a besoin pour :
- améliorer sa santé
- atteindre les objectifs des traitements (ralentir la progression de la maladie rénale, prévenir le risque cardio-vasculaire, éviter ou retarder les complications et contribuer à leur traitement)
- améliorer ou préserver sa qualité de vie.
L’éducation thérapeutique du patient (ETP) est une démarche systématique de soins et s’inscrit dans le parcours de soins du patient.
Elle peut être réalisée dans le cadre de programmes validés par les Agences Régionales de Santé; en dehors de ces programmes, par le médecin généraliste ou par les autres professionnels s’ils sont formés individuellement ou encore dans le cadre d’une prise en charge par les réseaux.
Les 4 étapes d’une démarche d’ETP sont systématisées :(L’éducation thérapeutique n’est pas une simple « information du patient ») :
1) Le diagnostic éducatif :
- Il est élaboré au cours d’une ou plusieurs séances individuelles, par un ou plusieurs professionnels, formés spécifiquement à l’ETP.
2) La définition d’objectifs partagés
- Ce sont les objectifs concernant les compétences à acquérir, et la stratégie de mise en œuvre de la démarche d’éducation, élaborée avec le patient.
3) La mise en œuvre des séances
- Les séances d’ ETP peuvent être collectives (préférentiellement) ou individuelles.
- Réalisées principalement par des équipes pluri professionnelles.
4) L’évaluation individuelle
- Au minimum à la fin de chaque cycle d’éducation thérapeutique. Cette évaluation doit permettre, pour chaque patient, d’apprécier le degré d’atteinte des objectifs fixés initialement, ainsi que la nécessité de conclure, poursuivre, compléter ou réorienter la démarche d’éducation thérapeutique.
Les thématiques abordées varient selon les besoins de chaque patient :
- Pré-dialyse : information sur les différentes modalités de traitement de l’insuffisance rénale, échange sur le vécu d’autres patients
- Soutien psychologique : comment accepter la maladie, s’ouvrir aux autres, accéder à la greffe dans de meilleures dispositions
- Vie quotidienne : garder son emploi, organiser ses vacances, équilibrer son alimentation
- Bien-être : activité physique adaptée, sophrologie
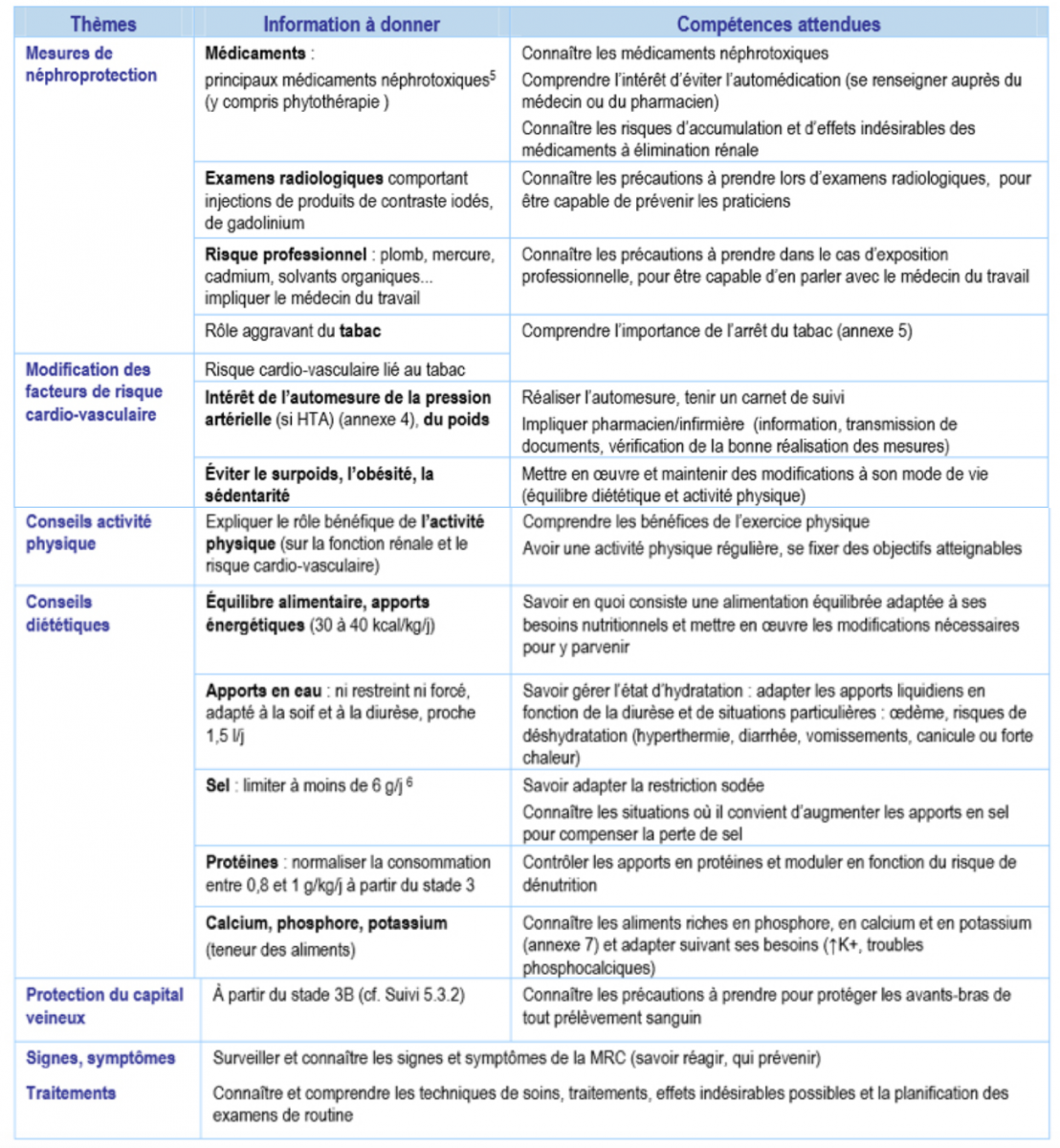
L’Objectif pour le patient maitrise :
- L’auto mesure de la pression artérielle (si HTA)
- La surveillance de son poids
- Les signes et symptômes de l’insuffisance rénale chronique
- La connaissance des médicaments néphrotoxiques
- L’absence auto médication (se renseigner auprès du médecin ou du pharmacien)
- La connaissance des risques d’accumulation et d’effets indésirables des médicaments à élimination rénale
- La connaissance des précautions à prendre lors d’examens radiologiques, pour être capable de prévenir les praticiens
D) Traitements impliqués dans la néphroprotection
- La néphroprotection c’est protéger le rein contre les mécanismes d’autodestruction. Dans les situations de réduction néphronique, les néphrons restés sains adaptent leur fonctionnement aux besoins de l’organisme, avec une augmentation de la filtration glomérulaire dans chaque unité fonctionnelle intacte.
- Ce processus, qui repose en grande partie sur l’activation du système rénine-angiotensine local, rétablit un débit de filtration glomérulaire global plus proche de la normale et peut être considéré comme bénéfique, à court terme.
- Cependant cet hyperfonctionnement met aussi en jeu divers systèmes cellulaires et humoraux qui vont progressivement entraîner des lésions de sclérose glomérulaire et de fibrose tubulo-interstielle.
- A moyen et à long terme, ces lésions irréversibles vont entraîner le déclin de la fonction rénale restante, même si l’agression initiale a cessé.
-
Outres les conseils diététiques et la maitrise des FDRCV. La prévention des épisodes d’insuffisance rénale aiguë, la prévention néphrotoxicité et le traitement de la maladie causale sont des éléments important de la néphroprotection.
-
Sur le plan pharmaceutique c’est les médicaments du système rénine angiotensine : les IEC (ou les ARA II) qui sont l’élément essentiel de la néphroprotection.
-
L’effet de néphroprotection est corrélé à la réduction de la protéinurie et au contrôle strict de l’hypertension artérielle.
-
Les médicaments du système rénine angiotensine permettent de ralentir la progression de la maladie rénale chronique par :
-
la baisse de la pression artérielle
- la baisse de la protéinurie conséquence de la diminution de la pression capillaire glomérulaire.
-
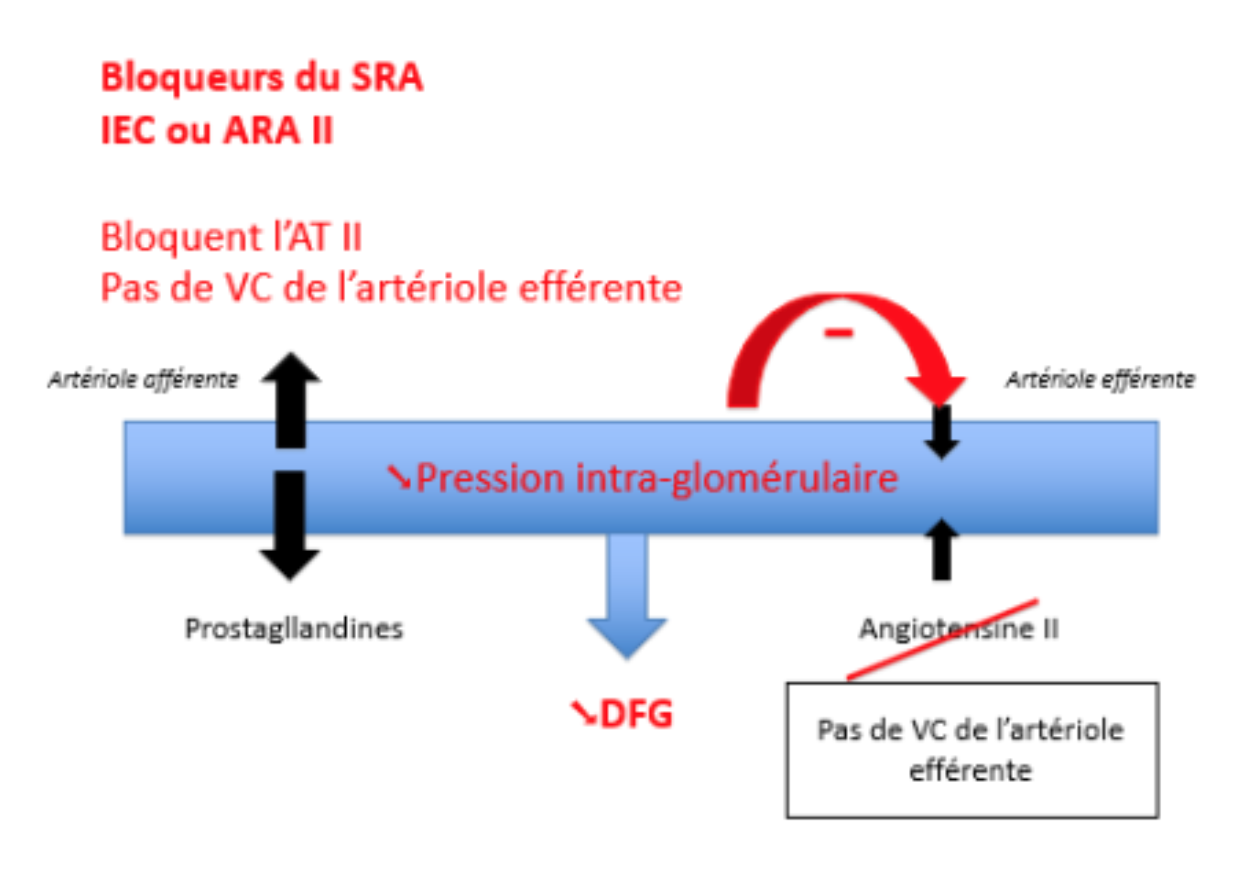
- Les IEC ont une action sur la Tension Artérielle ET sur la diminution de la protéinurie.
- Les recommandation pour le contrôle de l’HTA passe par : La limitation des apports sodés (< 6 grammes /jour)
- Un traitement anti hypertenseur en privilégiant les bloqueurs du système rénine angiotensine aldostérone : Inhibiteur de l’enzyme de coversion ou sartans, en privilégiant les IEC qui ont un ratio coût-efficacité plus favorable que les ARA II, les sartans sont de plus sous surveillance devant un possible risque oncogène lié à leur fabrication.
- L’initiation se fait à faible dose, l’augmentation est progressive, par paliers successifs sous contrôle de la pression artérielle, de la fonction rénale et de la kaliémie jusqu’à la dose maximale préconisée si tolérée.
-
Une augmentation de la créatininémie de 10 à 20 % témoigne de l’efficacité du traitement, elle ne justifie pas de diminution de la posologie. En cas d’augmentation de la créatininémie de plus de 30 %, arrêter temporairement l’IEC, qui pourra être réintroduit progressivement après avoir écarté une sténose d’artère rénale, et après une diminution des doses de diurétiques.
-
L’incidence de l’hyperkaliémie étant accrue du fait de l’insuffisance rénale et de l’acidose, elle nécessite d’être surveillée étroitement en cas de traitement par un IEC. En cas d’ hyperkaliémie supérieure à 6 mmol/L, arrêt temporaire. Pour une kaliémie comprise entre 5 et 6 mmol/L, rechercher un écart diététique et débuter éventuellement un traitement diurétique hypokaliémiant ou une résine absorbant le potassium alimentaire.
-
-
Lorsque les objectifs (réduction de l’albuminurie, normalisation de la pression artérielle) ne sont pas atteints, le traitement est modifié en associant plusieurs classes d’antihypertenseurs : bithérapie, puis trithérapie. En cas d’échec, un avis spécialisé néphrologique (ou cardiologique) est recommandé. Les associations IEC-ARA2 et/ou inhibiteur direct de la rénine doivent être évitées en dehors d’un avis spécialisé (risque d'angioedème bradykinique). Attention à la mise en route d’un traitement par IEC, surveiller la survenue : une hypotension ou une insuffisance rénale aiguë à l’introduction du traitement ou lors de l’augmentation des doses, surtout en cas d’hypovolémie ; une hyperkaliémie, surtout chez le diabétique ou en cas d’insuffisance rénale évoluée.
-
En cas de protéinurie sans HTA : un bloqueur du SRA doit quand même être utilisé ; la cible est d’obtenir une protéinurie < 0,5 g/g de créatinine ; avec la dose maximale tolérée pour que la PAS reste > 110 mmHg.
2) Autre traitement médicamenteux de néphroprotection :
- Traitements de la maladie causale
- Statines si dyslipidémie
- Autres pistes : Anti-aldostérone, I SGLT2 (Anti Diabétique Oral), EPO
3) La néphrotoxicité
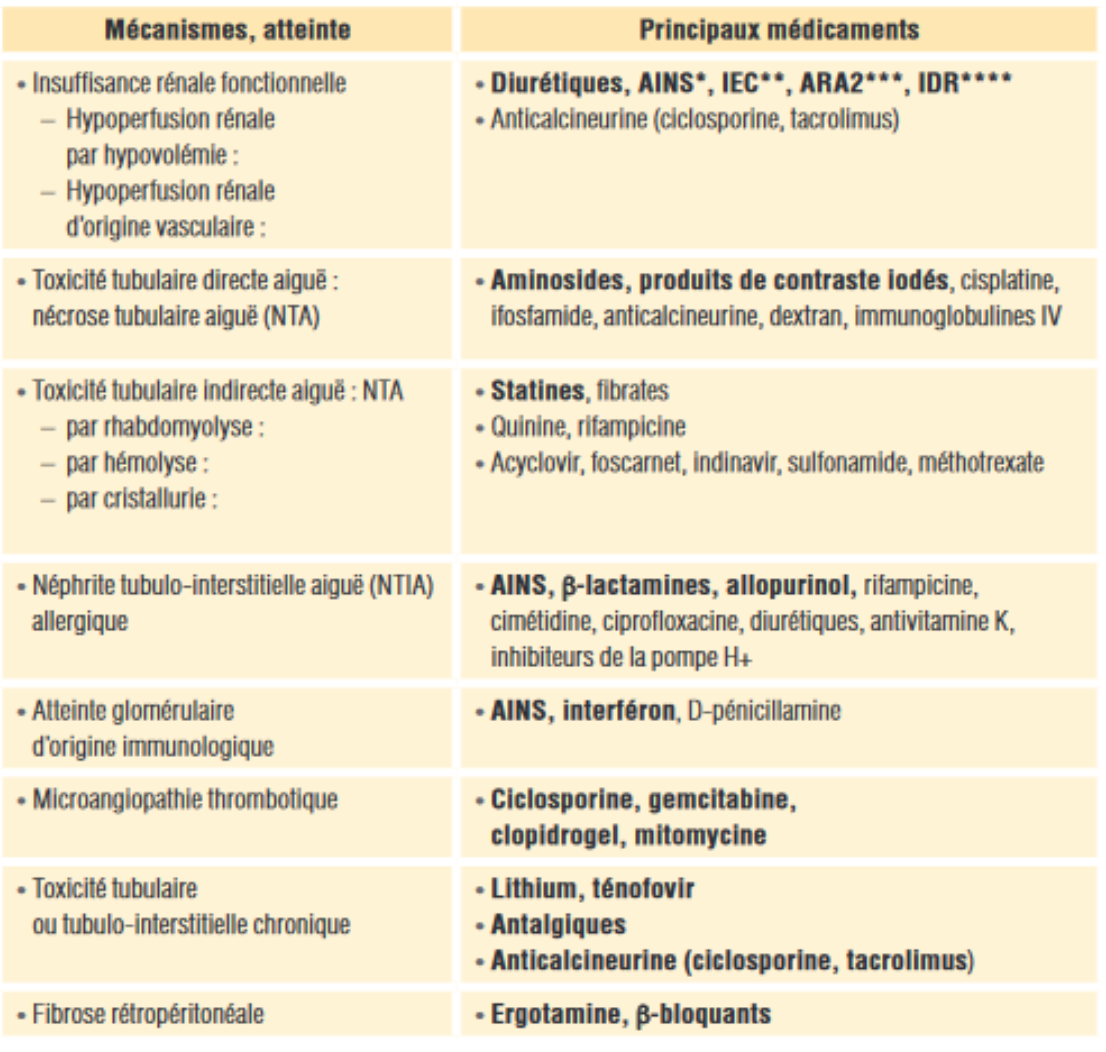
- Un médicament néphrotoxique peut induire des lésions rénales lors de l’élimination rénale du médicament (ou de ses métabolites) C’est donc un médicaments à éviter.
- Un médicament (ou métabolites) ayant une élimination rénale est un médicament utilisable en cas d’insuffisance rénale chronique On peut l’utiliser mais il faut adapter la posologie.
a) Les principaux traitements néphrotoxiques :
- Produits de contraste iodés
- Anti inflammatoire non stéroidien
- Antibiotiques : aminosides, vancomycine.
- Anticancéreux cisplatine, ifosfamide, méthotrexate,…
- Antiviraux, antifongiques : Amphotéricine B (Fungizone°),…
b) La néphrotoxicité des produit de contraste iodés :
- Risque : insuffisance rénale aiguë par nécrose tubulaire
- Objectif : Assurer une hydratation extra-cellulaire normale au moment de l’injection d’iode
- Moyens : arrêter les diurétiques 3 jours avant l’examen et arrêter le régime désodé si pas de signe congestif faire boire eau de Vichy la veille et le jour de l’examen ou faire perfuser soluté salé 1 litre la veille et le jour de l’examen
- surveillance : contrôle de la créatininémie 48-72h après l'injection d'iode
+ Pour la metformine :
- Les patients ayant une fonction rénale normale peuvent continuer leur traitement.
- Afin d’éviter une acidose lactique chez le diabétique traité par metformine et atteint d’insuffisance rénale modérée, la metformine doit être arrêtée 48 heures avant l’examen et n’est réinstaurée qu’après 48 heures, si la créatininémie est inchangée.
+ Le gadolinium :
- En cas d’insuffisance rénale chronique, l’utilisation des produits de contraste à base de gadolinium n’est pas dénuée d’effets secondaires potentiels et peut aboutir à une fibrose néphrogénique systémique.
- L’administration de gadolinium chez les insuffisants rénaux chroniques nécessite une indication formelle, en particulier chez les patients à haut risque (Débit de filtration glomérulaire < 30 ml/min).
- Les chélateurs de gadolinium cycliques ioniques devraient être utilisés préférentiellement en raison de leur stabilité chez les patients à haut risque ( Dotarem ®, Gadovist ®, Prohance ®, Multihance).
c) La néphrotoxicité des produit des Anti inflammatoires non stéroidien :
- Est à plusieurs niveaux : insuffisance rénale fonctionnelle, NTIA, atteinte glomérulaire, voir IRC.
- Les AINS (inhibiteurs sélectif de la COX2 inclus) sont susceptibles d’induire une IRF surtout dans les situations où le maintien de la perfusion rénale repose sur les prostaglandines vasodilatatrices :
- hypovolémie vraie : déshydratation extracellulaire ;
- hypovolémie relative avec hypotension artérielle : hypoalbuminémie, décompensation oedémato-ascitique, bas débit cardiaque ; sténose d’artère rénale et néphroangiosclérose avancée ; glomérulosclérose diabétique.
- Mesures préventives pour la prescription des AINS : prescription limitée dans le temps chaque fois que possible ; ne pas associer des antagonistes du SRA ou d’autres médicaments néphrotoxiques.
Surveiller la tolérance si l’association est indispensable (rétention hydrosodée, fonction rénale, kaliémie, protéinurie).
-
Stade 3 de MRC : DFG estimé est entre 30 et 60 ml/min. La prescription doit être limitée à 3 à 5 jours sous surveillance
-
Stade 4 et 5 : les AINS sont contre-indiqués
d) Néphrotoxicité par défaut d’adaptation de posologie des médicament à élimination rénale :
- Le contrôle des prescriptions médicamenteuses et l’ajustement des posologies des médicaments à élimination rénale est indispensable au moment de la prescription et du suivi des médicaments, il convient de :
- Suivre les précautions définies dans les AMM des produits
- Se référer en ligne sur le site http://sitegpr.com/fr/
- La formule qui doit être utilisée reste la formule de Cockcroft et Gault.
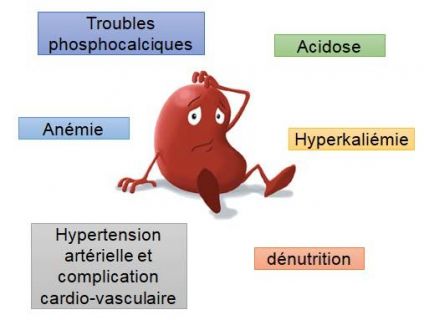
E) Traitements des complications
Les reins ont trois types de fonctions :
- Elimination de toxines : notamment de toxines dérivées du catabolisme azoté
- Homéostasie : régulation hydroélectrolytique et de l’équilibre acide-base
- Fonction endocrine : synthèse de rénine, d’érythropoïétine et de vitamine D active.
D’une manière générale, ces fonctions sont assurées tant que le débit de filtration glomérulaire est supérieur ou égal à 60 ml/min/1,73 m2. En dessous de 60 ml/min/1,73 m2 de DFG les complications de l’IRC apparaissent (stade 3 de la MRC,)
1) Les conséquences hématologiques de l’IRC
a) Anémie normochrome, normocytaire, arégénérative Le défaut de synthèse rénale d’érythropoïétine entraîne une anémie
Évaluation initiale hémogramme avec plaquettes et compte de réticulocytes ferrritine sérique et fer sérique, coefficient de saturation de la transferrine. +/- • CRP ; • vitamine B12, folates • électrophorèse de l’Hb • électrophorèse des protéines plasmatiques • myélogramme • tests d’hémolyse.
Avant d’envisager un traitement par Agents Stimulants de l’Erythropoïèse (ASE) traiter en priorité :
- une carence en fer (avec un objectif de taux de ferritine > 100μg/l) :
Il existe en effet une fréquence accrue de la carence martiale au cours de l’insuffisance rénale chronique (absorption intestinale diminuée) sa recherche est donc indispensable en cas d’anémie.
- une carence en folates ou en vitamine B12
- un syndrome inflammatoire.
Seuil de traitement par ASE : Hb < 10 g/dl. Le traitement par ASE est systématiquement associé à un traitement en fer ;
La prescription initiale d’ASE est réservée aux néphrologues, renouvellement possible par le médecin traitant sur ordonnance de médicament d’exception.
Objectifs :
- Hb entre 11 et 12 g/dl ;
- ferritinémie supérieure à 100 μg/l
- ou coefficient de saturation de la transferrine supérieur à 20 %
- ou pourcentage de globules rouges hypochromes inférieur à 6 %.
Surveillance du traitement ASE : renforcement de la surveillance de la TA pendant la phase d’instauration ; élévation de l’Hb < 2 g/dl par mois ;
Les transfusions doivent être évitées chez l’IRC en vue d’une éventuelle transplantation ultérieure (risque d’allo-immunisation) : (développement d’anticorps anti-HLA).
b) Troubles de l’hémostase primaire
- Les hémorragies sont plus fréquentes au cours de l’IRC avancée (saignements digestifs occultes, règles prolongées). Seule l’hémostase primaire est anormale, le TS est allongé, du fait d’un défaut d’agrégation plaquettaire et d’une baisse de l’hématocrite.
- Attention : les héparines fractionnées de bas poids moléculaire , HBPM (type Lovenox®ou Fraxiparine®) sont contre-indiquées lorsque le DFG est < à30 ml/min, du fait de leur élimination rénale qui entraîne un risque d’accumulation.
- De même, attention aux prescriptions d’agents anti-agrégants ou anticoagulants
c) Déficit immunitaire
- Modéré mais indiscutable, il a été montré que l’insuffisance rénale était associée à une baisse des réponses immunes cellulaires et humorales, dont l’importance suit celle de l’insuffisance rénale. Il se caractérise notamment par une réponse atténuée aux vaccinations.
- De plus, les patients porteurs d’insuffisance rénale présentent souvent d’autres pathologies, en particulier des pathologies cardio-vasculaires ou du diabète et tout événement infectieux est à risque d’aggraver une insuffisance rénale quel qu’en soit le stade.
Les recommandations vaccinales dans l’IRC sont les vaccinations obligatoires+ vaccination anti grippale+ vaccination anti pneumoquoccique+ vaccination contre l’hépatite B à partir du stade 3B
- De ce fait, les recommandations vaccinales du patient IRC préconisent, en plus des vaccinations habituelles de la population adulte (diphtérie, tétanos, poliomyélite, coqueluche, etc.) :
- une vaccination contre la grippe quelque soit l’age
- une vaccination contre les infections à pneumocoque
- Et lorsque le débit de filtration glomérulaire est inférieur à 45ml/min/1,73 m², vaccination contre l’hépatite B.
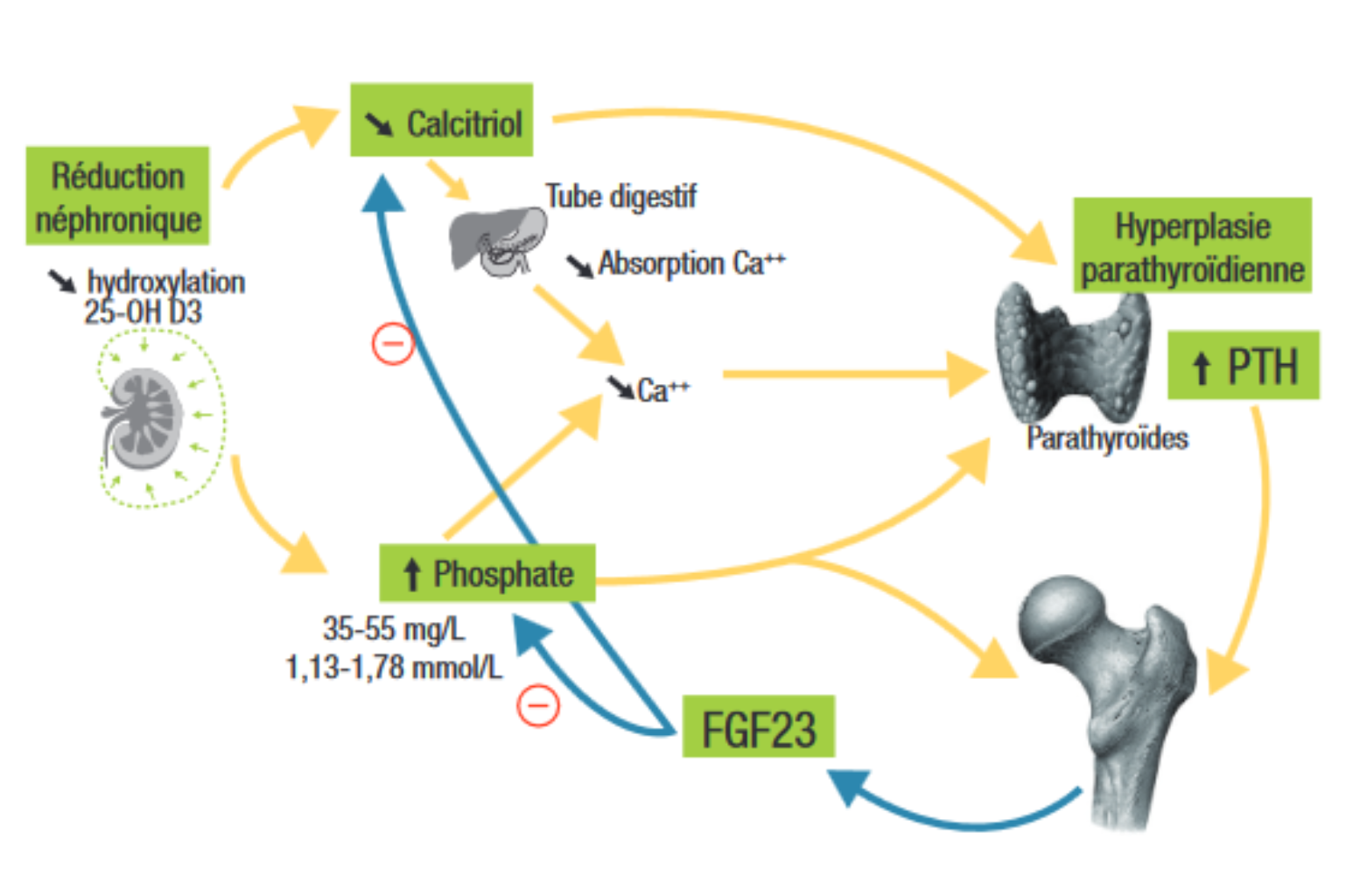
2) Les conséquences sur le métabolisme phosphocalcique et osseux :
- hyperparathyroïdie secondaire, précoce
- déficit en vitamine D active
- hypocalcémie
- hyperphosphatémie, liée à la diminution de l’excrétion rénale des phosphates
De plus l’acidose métabolique aggrave les lésions osseuses
2 grands types de lésions osseuses peuvent s’associer à des degrés divers pour constituer la maladie osseuse rénale (anciennement ostéodystrophie rénale):
a) l’ostéomalacie (diminution de la formation osseuse) secondaire au déficit en vitamine D :
signes cliniques : douleurs osseuses rares, signes radiologiques : déminéralisation, stries de Looser-Milkman signes biologiques : en pratique seule la carence en vitamine D native est évaluée.
b) l’ostéite fibreuse (destruction osseuse accélérée) secondaire à l’hyperparathyroïdie :
- signes cliniques : douleurs osseuses, signes radiologiques : résorption des extrémités osseuses (phalanges et clavicules), lacunes au niveau des phalanges des doigts, déminéralisation, signes biologiques : PTH augmentée.
- Cette fragilisation de l’os est à l’origine d’un risque fracturaire accru chez le patient présentant une insuffisance rénale chronique.
La prévention des troubles phosphocalciques nécessite :
- Des apports en vitamine D3 naturelle (ex. Uvedose®) en cas de carence
- Une restriction des apports alimentaires en phosphore
- + des apports calciques mais sans excès
- Des traitements complexants du phosphore existent, leur prescription est rarement nécessaire avant le stade 5.
- Exceptionnellement, la parathyroïdectomie est nécessaire avant le stade terminal en cas d’hyperparathyroïdie secondaire échappant au traitement médical.
Les objectifs de traitement :
- une calcémie normale,
- une phosphatémie inférieure à 1,5 mmol/L,
- une PTH normale avant le stade de la dialyse, puis entre 2 et 9 fois la borne supérieure de la normale chez le patient traité par dialyse.
3) Les conséquences sur l’équilibre acide-base
- Une acidose métabolique survient au cours de l’IRC (en raison d’un défaut d’élimination de la charge acide).
- Elle est généralement modérée avec : diminution des bicarbonates et augmentation faible du trou anionique, pH conservé jusqu’à un stade évolué des MRC.
- Cette acidose métabolique chronique a pour conséquences :
- un catabolisme protéique musculaire excessif,
- une aggravation des lésions d’ostéodystrophie rénale,
- une majoration du risque d’hyperkaliémie.
- La correction de l’acidose métabolique a pour objectif une bicarbonatémie supérieure à 22 mmol/L
- Elle nécessite l’utilisation d’alcalinisants type bicarbonate de sodium (ex. : gélules de bicarbonate de sodium, 3 à 6 grammes par jour) ou eau de Vichy (0,5 à 1l/j).
4) Les conséquences métaboliques
a) La dénutrition protéino-énergétique, en lien avec :
- Une anorexie : réduction spontanée des apports alimentaires
- une augmentation du catabolisme protéique (du fait de l’acidose)
- une diminution des synthèses protéiques, liée à la résistance périphérique à l’action anabolisante de l’insuline.
La prise en charge diététique fait partie du suivi des patients avec MRC, avec comme objectifs :
- Assurer des apports caloriques suffisants (≥ 30 kcal/kg/jour)
- Éviter les carences protéiques, notamment dans le cadre de la restriction protéique prescrite pour ralentir la progression de la MRC, apport protéique de 0,8 g/kg/jour, ne pas les restreindre plus. Vérification possible des apports protéiques effectif du patient à partir du dosage de l’urée des urines des 24 h.
- Correction des troubles phosphocalciques et de l’acidose métabolique.
Intérêt du suivi clinique :
- Poids,
- IMC,
- évaluation de l’état nutritionnel (suivant les questionnaires Self Global Assessment (SGA) ou Mini Nutritional Assessment® (MNA) …)et biologique ( albuminémie, urée sanguine, à partir du stade 3B), ces marqueurs nutritionnels sont des facteurs prédictifs majeurs de mortalité.
- Indication de prescription de compléments alimentaires si patient dénutri +/- suppléments vitamines (vit D, B1, B2, B6, vit C, acide folique, vit E)
b) Hyperkaliémie
- L’hyperkaliémie est définie par une concentration plasmatique du potassium supérieure à 5,0 mmol/L. La majorité des hyperkaliémies sont dues à des insuffisances rénales et à la prise de médicaments.
- 95% du potassium filtré est réabsorbé au niveau du tubule contourné proximal et de l'anse de Henle. Seuls 2% du potassium filtré atteignent le tubule contourné distal et l'essentiel du potassium urinaire provient de sa sécrétion par le tubule distal tardif et le canal collecteur.
- Dans l'insuffisance rénale chronique, tant que la clairance de la créatinine est au-dessus de 10 ml/min, la capacité d'élimination du potassium (rénale et digestive) reste suffisante pour compenser les apports en potassium.
- Dans des situations d'hypoaldostéronisme hyporéninisme (comme le diabète) ou avec certains médicaments (IEC, anti-AT II), une hyperkaliémie peut apparaître pour des clairances moins basses.
- Les manifestations les plus graves sont cardiaques mais d'autres atteintes notamment neuromusculaires peuvent être au premier plan (parésies).
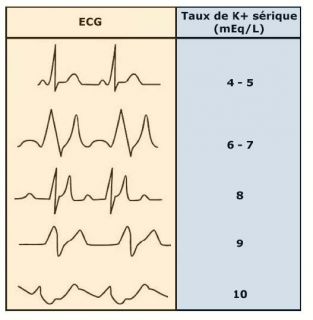
- Un ECG doit être réalisé devant toute hyperkaliémie
- Une Hyperkaliémie >6 mmol/l doit être prise en charge en milieu hospitalier : Anomalies ECG de l’Hyperkaliémie
Ondes T amples, positives, symétriques et pointues, à base étroite Elargissement des QRS > 0,12 sec (conduction intraventriculaire) Déviation axiale gauche fréquente Elargissement et diminution de l’amplitude puis disparition de l’onde P pseudo ST+ Arythmies (TV, FV) BAV Asystolie
- Prise en charge de l’hyperkaliémie Si K+ > 6 mmol/L ou signes ECG d’hyperkaliémie : Surveillance scopée, voie veineuse périphérique et chariot d’urgence à proximité.
- si K+ < 6 mmol/L ou absence de signe ECG Résines échangeuses d’ions (échange, au niveau de la muqueuse digestive colique, de potassium contre un autre ion). Le sulfonate de polystyrène sodique (KAYEXALATE®) échange un ion potassium contre un ion sodium. Il est administré per os (15 à 30 g, soit 1 à 2 Cuillère Mesure ) toutes les 4 à 6 heures mais n’agit qu’en quelques heures. Surveillance de la kaliémie sous traitement + arrêt des médicaments hyperkaliémiants.
c) L’hyperuricémie
- Fréquente au cours de l’insuffisance rénale Symptomatologie variable, souvent asymptomatique
- Traitement de la crise : Attention à l’utilisation de la colchicine chez le patient insuffisant rénal avec un débit de filtration glomérulaire < 30 ml/min, corticoïdes à privilégier en cas de poussées ou antalgique de palier 1 ou 2
- Traitement préventif : Ne traiter en préventif que si symptomatique (Allopurinol), adapter la posologie en fonction de l’insuffisance rénale
Les conséquences en cas de SUPPLEANCE TROP TARDIVE OU INSUFFISANTE
Les conséquences digestives : nausée, vomissement, ulcère gastro duodénal Les conséquences neurologiques:
- Crampes
- Troubles du sommeil
- Polynévrite urémique (ne doit plus exister)
- Encéphalopathie urémique (ne doit plus exister)
Les conséquences cardiaques : Péricardite urémique
F) Prise en charge psycho-sociale
L’insuffisance rénale chronique pose outre les problèmes médicaux classiques des problèmes d’ordre familial, professionnel et psychologique surtout vers le terme de son évolution, lorsqu’un traitement de substitution doit être envisagé.
La prise en charge de ces problèmes doit commencer bien avant la date de début de l’épuration extrarénale, voire avant la préparation « médicale » comprenant la vaccination contre l’hépatite B et la création de l’abord vasculaire.
La première étape comprend l’information et l’éducation thérapeutique du patient.
La meilleure façon d’aborder la situation semble être la prise en charge personnelle de son traitement par le patient lui-même pour optimiser l’adhésion au traitement et son acceptation.
Mais il convient aussi de prévoir notamment :
- Un entretien avec une assistante sociale
- Un soutien psychologique
- L’orientation vers les associations de malades.
Le recours au service d’assistance social est une aide précieuse pour le patient pour :
- évaluer sa situation sociale ;
- l’informer sur les droits, les aides éventuelles et les démarches administratives à effectuer ;
- le conseiller, l’orienter vers les lieux, organismes, administrations appropriées ;
- l’accompagner tout au long de ses démarches.
A domicile, l’objectif est de prévoir et coordonner les possibilités d’aides du patient, (aide ménagère, portage des repas, l’intervention des structures adaptées) Et de son entourage.
Le rôle des aidants est primordial dans le maintien à domicile de la personne aidée. Mais beaucoup risquent de s’épuiser dans cette relation d’aide très exigeante.
Le médécin généraliste à un rôle central dans dépistage, la mise en place et le suivi de cette prise en charge.
Les structures mobilisables pour la mise en place des dispositifs, la coordination et l’information des patients :
- réseaux de soins,
- centres communaux d’action sociale (CCAS),
- centre locaux d’information et de coordination (CLIC) ;
Pour la prise en charge financière de ces aides, recours possible à :
- l’allocation personnalisée d’autonomie (APA),
- l’aide sociale départementale,
- l’aide des caisses de retraite et certaines mutuelles.
Sur le plan socio-professionnel,
- Lorsque la maladie chronique devient un obstacle pour obtenir ou conserver un emploi, le médecin traitant ou le néphrologue peut:
- Demander une reconnaissance de la qualité de travailleur handicapé (RQTH) auprès de la MDPH.
La demande est à faire par le patient auprès de la MDPH, Maison Départementale pour les Personnes Handicapées. La partie médicale du dossier est à remplir par le néphrologue ou le médecin traitant.
- Être en lien si besoin avec le médecin du travail
Pour l’HAS, un soutien psychologique est indiqué dans les situations suivantes :
- Dénutrition (dans un contexte de solitude et/ou état dépressif) ;
- Préparation aux traitements de suppléance ;
- Traitement palliatif
Mais il semble licite de l’évoquer avec tout patient insuffisant rénal chronique.
Un soutien par un psychologue devrait être systématiquement proposé pour pouvoir aider tout patient atteint d’insuffisance rénale à aborder les problèmes à venir le plus sereinement possible.
Le retentissement d'une maladie chronique entraîne parfois des modifications du caractère et du comportement qui peuvent rendre les relations avec l'entourage difficile et un créer un mal être pour le patient.
Dans le cadre de la transplantation, le soutien psychologique est primordial :
Le passage de l'état de dialysé à l'état de transplanté est une véritable rupture dans la vie de l'insuffisant rénal et il est classique de constater un état dépressif succédant à la transplantation, qui pourtant libère considérablement le patient, et dont celui-ci se sent bien souvent coupable.
La transplantation, bien qu'elle procure une vie plus facile, n'entraîne pas une guérison définitive. Les conséquences psychologiques de la maladie chronique sont toujours présentes, sans oublier, pour certains, les perturbations provoquées par la présence en eux d'un organe étranger.
La maladie chronique peut aussi être le révélateur ou la cause de souffrances ou de maladies psychiques, et de difficultés sociales chez les patients et leur entourage.
Des troubles psychiques (stress, anxiété, troubles du sommeil, dépression), Ou des addictions préexistantes ou consécutives à la maladie peuvent nécessiter une prise en charge spécifique
L’orientation vers les associations de patients est souvent bénéfique pour le patient.
Elles permettent de trouver un espace de convivialité. Cela permet au patient de poser des questions, partager ses expériences,… L’association, c’est aussi un moyen pour le patient d’agir pour les autres.
Exemple : France Rein, Renaloo,…
ÉVOLUTION/PRONOSTIC
Votre texte ici
PRÉVENTION
Votre texte ici
SURVEILLANCE
A) Evaluation initiale et suivi de l’insuffisance rénale
Dépistage au sein de la population à risque : 1 fois par an
- Estimation du débit de filtration glomérulaire (DFG estimé) réalisée à partir du dosage de la créatininémie
- Albuminurie réalisée sur un échantillon urinaire à tout moment de la journée, résultat exprimé sous la forme d’un ratio albuminurie/créatininurie.
La barrière de filtration glomérulaire (BFG) ne laisse habituellement pas passer les protéines qui sont retenues grâce à leurs taille et charge.
Le tubule rénal proximal participe à la réabsorption des protéines de petite taille et à la fraction d’albumine qui passent cette barrière.
Des anomalies de la BFG et du tubule peuvent engendrer l’apparition d’une albuminurie et d’une protéinurie.
La protéinurie physiologique est composée de :
- 60 % de protéines de faibles poids moléculaire (lysozyme, B2 microglobuline et chaînes légères kappa et lambda).
- 40 % de protéines secrétées par le tubule (uromoduline ou protéine de Tamm-Horsfall) ou par l’urothélium des voies urinaires.
L’albumine est une protéine globulaire hydrosoluble avec un poids moléculaire de 65 kDa fabriquée par le foie.
La quantité d’albumine filtrée dans des conditions physiologiques est débattue.
Elle est ensuite réabsorbée dans le tubule proximal et n’apparaît pas en quantité significative dans les urines.
Vu la taille de l’albumine (<70 kDa) elle devrait être théoriquement librement filtrée.
Mais la présence de glycocalyx, chargé négativement à la surface des cellules endothéliales, restreint ce passage puisque l’albumine est aussi chargée négativement.
Les protéines traversent ainsi la BFG de manière inversement proportionnelle à leurs tailles et à leurs charges négatives.
L’albuminurie est un reflet d’une lésion de la barrière glomérulaire, qui en laisse passer une quantité plus importante et ne sera pas plus réabsorbée par le tubule (par phénomène de saturation de la réabsorption).
Elle peut précéder la survenue d’une baisse du DFG.
L’albuminurie n’est pas spécifique d’une maladie mais est spécifique du compartiment atteint.
Une protéinurie composée à plus de 50% d’albumine, est considérée comme une protéinurie d’origine glomérulaire.
Elle est dite sélective si supérieur 80% albumine et non sélective si entre 50 et 80 %.
Une protéinurie composée à moins de 50% d’albumine est considérée comme d’origine tubulaire ou de surcharge (nécessité alors de rechercher la présence de chaines légères en cas de protéinurie avec albuminurie minoritaire).
En présence d’une protéinurie, il est essentiel de déterminer sa composition et sa quantité afin d’avoir une idée des mécanismes qui l’ont engendrée.
Pour ce faire, il est important d’obtenir simultanément les rapports urinaires protéine/créatinine et albumine/ créatinine.
Des examens plus poussés peuvent ensuite se discuter (électrophorèse et immunoélectrophorèse des protéines urinaires).
Si positivité (DFG<60 l/min/1,73 m² ou albuminurie >30mg/l)
Le diagnostic doit être confirmé en répétant les tests du dépistage :
- par la persistance d’une diminution du DFG (DFG < 60m l/min/1,73 m²) sur deux ou trois examens consécutifs positifs réalisés dans les trois mois et avec la même technique de dosage de la créatininémie ; ou
- par la persistance d’une albuminurie sur deux ou trois examens consécutifs positifs réalisés dans les 3 mois.
Affirmation du caractère chronique lorsqu’un des signes d’atteinte rénale persiste pendant plus de 3 mois :
- diminution du DFG : DFG < 60ml/min/1,73 m² ;
- protéinurie ou albuminurie ;
- hématurie : GR > 10/mm3 ou 10 000/ml (éliminer une cause urologique) ;
- leucocyturie : GB >10/mm3 ou 10 000/ml (en l’absence d’infection) ;
- anomalie morphologique à l’échographie rénale : asymétrie de taille, contours bosselés, reins de petite tailles ou gros reins polykystiques, néphrocalcinose, kyste.
Après confirmation du diagnostic de MRC, l’évaluation initiale est réalisée avec pour objectifs :
- d’orienter le diagnostic étiologique,
- d’évaluer le stade, l’évolutivité et le retentissement de la MRC ;
- de définir la stratégie de traitement, les modalités de surveillance et les différents professionnels à impliquer dans la prise en charge, en prenant en compte le patient dans sa globalité (âge, situation médicale, familiale, sociale, professionnelle) ;
- de proposer au patient la stratégie thérapeutique et de s’accorder avec lui sur les éléments prioritaires à mettre en œuvre ;
- d’élaborer avec le patient, à l’issue de cette démarche, son programme personnalisé de soins (PPS).
1) Orienter le diagnostic étiologique
L’étiologie de la maladie rénale chronique est importante à rechercher, elle peut impliquer une prise en charge thérapeutique spécifique (ex. : immunosuppresseurs et stéroïdes dans les néphropathies glomérulaires). Le diagnostic étiologique est d’autant plus possible que la MRC est moins évoluée. Aux stades évolués d’atrophie rénale (traduisant une fibrose rénale), les lésions touchent toutes les structures, empêchant souvent le diagnostic causal. Les questions à formuler pour rechercher une cause à la MRC :
1/Y a-t-il un obstacle chronique ?
- Toutes les causes d’obstacle chronique négligé peuvent aboutir à une IRC.
- Plus l’obstacle sera levé tardivement et plus la récupération de la fonction rénale sera incomplète.
- L’examen clinique (globe vésical, gros rein et touchers pelviens si nécessaire)
- et l’échographie vésicale (résidu post-mictionnel),des reins et des voies excrétrices (dilatation des cavités pyélocalicielles) doivent être systématiques.
2/La MRC est-elle d’origine glomérulaire ?
- À l’interrogatoire : recherche diabète, lupus,..
- antécédents personnels ou familiaux de protéinurie ou d’hématurie.
- Protéinurie faite d’albumine (> 50 %)
- HTA et la rétention hydrosodée fréquentes
- 1ère cause = Diabète
3/La néphropathie chronique est-elle d’origine interstitielle ?
- A l’interrogatoire recherche : antécédents urologiques, notamment d’infections urinaires hautes, prise de médicaments néphrotoxiques, en particulier d’antalgiques ou l’exposition à des toxiques.
- protéinurie généralement modérée, tubulaire avec moins de 50 % d’albumine,
- une leucocyturie sans germes,
- l’HTA et la rétention hydrosodée sont plus tardives
4/La néphropathie chronique est-elle d’origine vasculaire ?
- A l’interrogatoire recherche : HTA ancienne et mal contrôlée, facteurs de risque vasculaire et antécédents cardio-vasculaires,
- dégradation de la fonction rénale sous inhibiteurs de l’enzyme de conversion de l’angiotensine ou antagonistes des récepteurs AT1 de l’angiotensine II.
- Le bilan comprend une échographie Doppler des artères rénales
- Les néphropathies vasculaires associent à des degrés divers, sténoses des artères rénales, néphroangiosclérose et emboles de cristaux de cholestérol
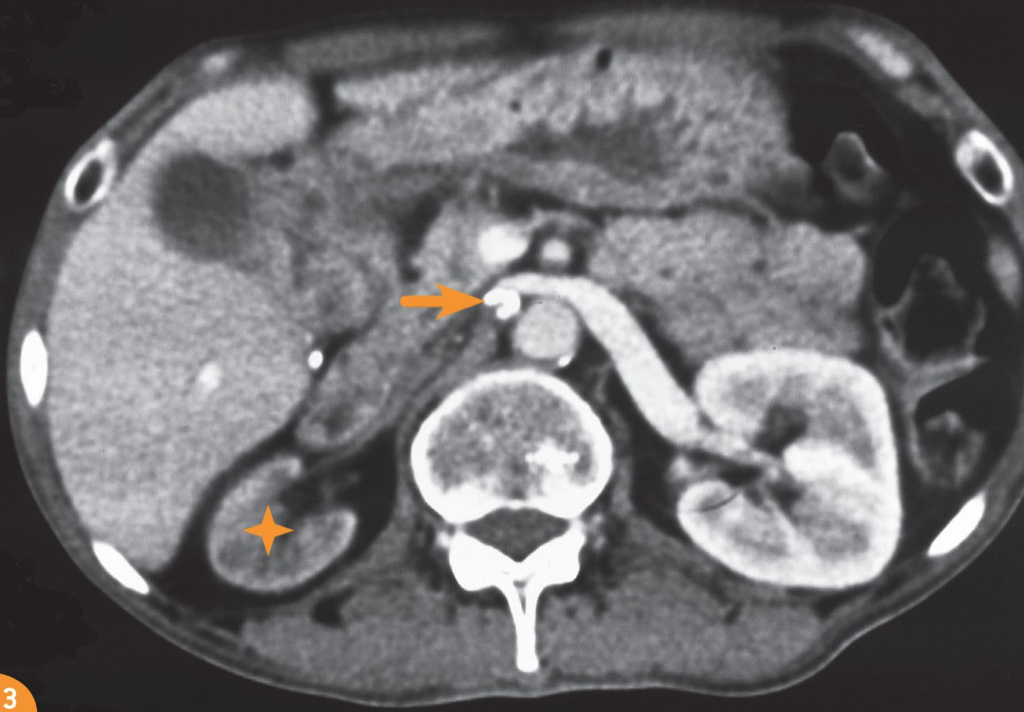
5/La néphropathie chronique est-elle héréditaire ?
- Les antécédents familiaux de néphropathie doivent être systématiquement recherchés : faire un arbre généalogique.
- Les étiologies les plus fréquentes de MRC génétique chez l’adulte sont :
- la polykystose rénale autosomique dominante, et le syndrome d’Alport de transmission en général liée à l’X
Particularités pouvant orienter le diagnostic étiologique :
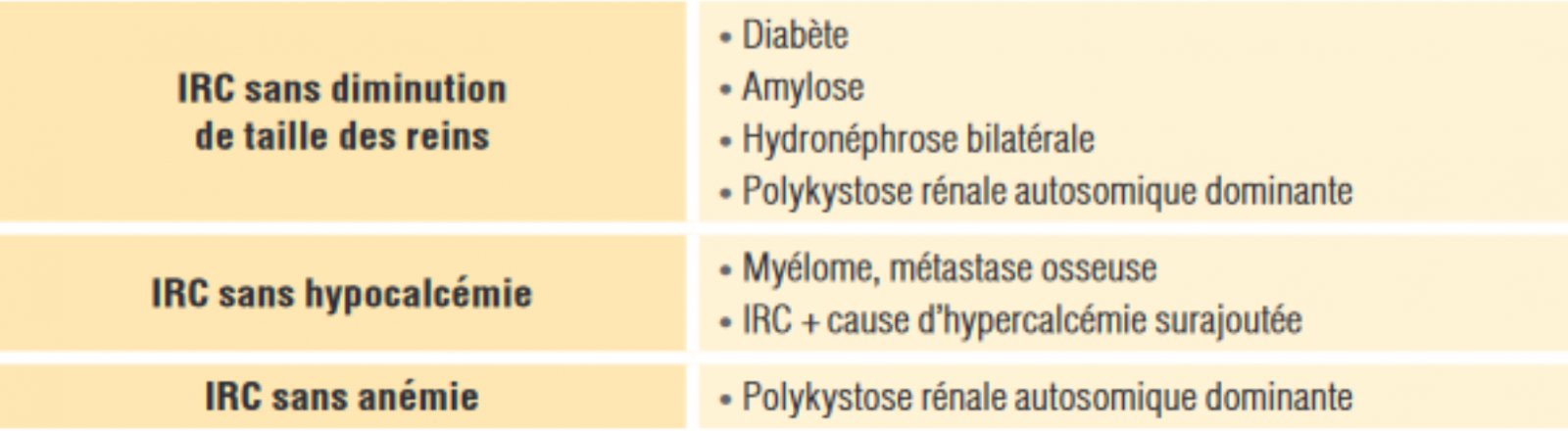
2) Évaluer le stade de la maladie rénale chronique
- Le stade de maladie rénale chronique est défini à partir du DFG estimé et de la présence de marqueurs d’atteinte rénale.
- Un cosuivi partagé néphrologue-médecin généraliste est recommandé à partir du stade 3B.
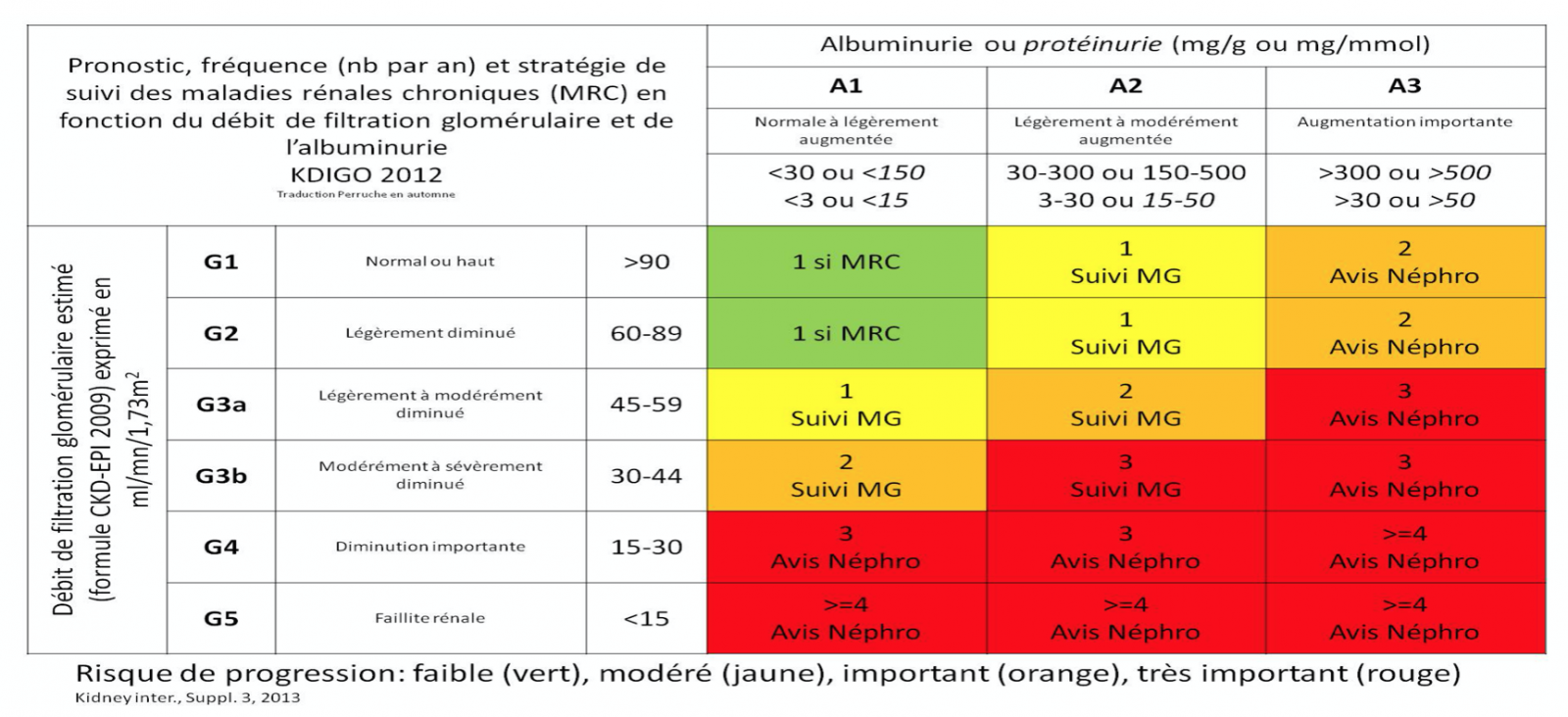
3) Évaluer la progressivité de la maladie rénale chronique
La maladie rénale chronique est considérée comme évolutive, c'est-à-dire à risque de progression vers l’IRCT, dans les situations suivantes :
a) Déclin annuel rapide du DFG
Le déclin annuel est calculé de la manière suivante : DFG année n – DFG année n+1
Il est évalué avec les repères suivants :
- déclin annuel « physiologique » observé après 40 ans : < 2 ml/min/1,73 m²/an,
- déclin annuel « modéré » : ≥ 2 et < 5 ml/min/1,73 m²/an,
- déclin annuel « rapide » : ≥ 5 ml/min/1,73 m²/an
b) Présence d’albuminurie
Le risque d’évolution vers le stade d’IRCT n’est pas seulement fonction du DFG mais aussi de la présence et de l’importance de l’albuminurie. Toute albuminurie persistante doit faire l’objet d’un avis néphrologique.
Les recommandations de suivi clinique et biologique de la progression sont :
- Vert : 1 fois par an.
- Jaune : 2 fois par an.
- Orange : 3 fois par an.
- Rouge : minimum 4 fois par an voire une fois par mois (par exemple juste avant la mise en dialyse).
c) Absence de contrôle de la pression artérielle (c'est-à-dire lorsque la pression artérielle n’atteint pas l’objectif thérapeutique).
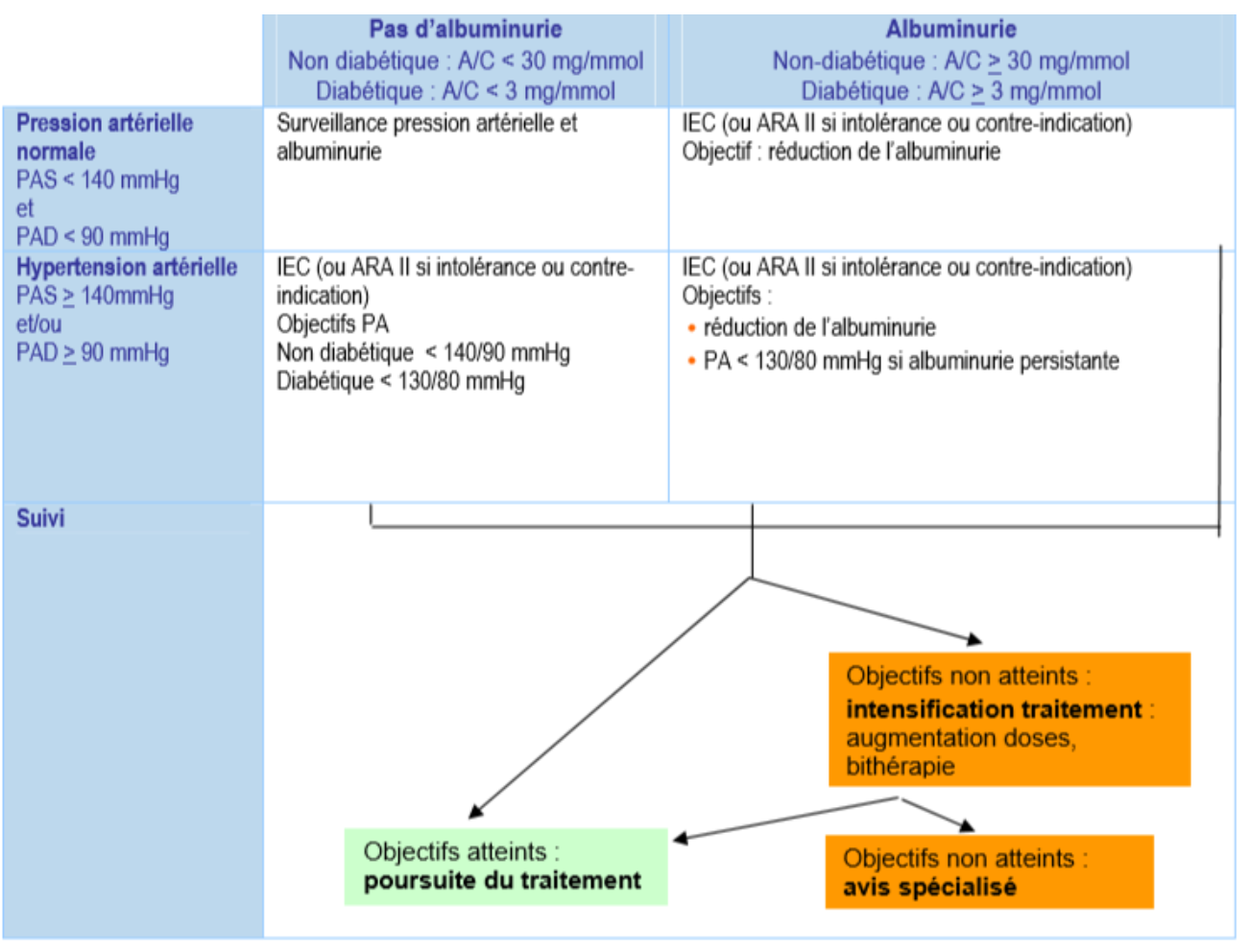
La pression artérielle doit être :
- <130/80 mmHg chez les patients ayant une maladie rénale chronique avec une albuminurie ≥ 30 mg/g de créatininurie qu’ils soient diabétiques ou non ;
- < 140/90 mmHg chez les patients ayant une MRC avec une albuminurie < 30 mg/g de créatininurie
- >110 mmHg de systolique dans tous les cas.
L’automesure tensionnelle est la référence et permet d’impliquer le patient dans sa prise en charge.
Les valeurs cibles sont inférieures de 5 mmHg aux valeurs de cabinet (PAS < 125 mmHg en automesure pour 130 mmHg au cabinet).
Quel que soit le stade de la MRC, ces situations nécessitent un recours au néphrologue pour décider du traitement et des modalités de suivi.
4) Évaluer le risque cardio-vasculaire global
Recherche des facteurs de risque cardio-vasculaire et évaluation du risque cardiovasculaire global qui est élevé dans le cas de la MRC. Recherche de maladies cardio-vasculaires en particulier athéromateuses
5) Annoncer le diagnostic à deux niveaux :
- La maladie rénale chronique en insistant sur l’importance des habitudes de vie et des traitements pour influencer favorablement l’évolution de la maladie (ralentissement de la progression de la maladie et de ses complications).
- Le suivi, l’adhésion aux traitements, aux modifications apportées au mode de vie ainsi qu’aux mesures de néphroprotection.
6) Élaboration du « programme personnalisé de soins »
- La prise en charge thérapeutique et les modalités de suivi sont définies et discutées avec le patient.
- Le programme personnalisé de soins comprend, en fonction de la clinique et de la situation familiale et sociale du patient :
- la définition des objectifs prioritaires et des actions à mettre en œuvre pour une prise en charge optimale de la MRC, des facteurs de risque et comorbidités associés ;
- la planification de l’intervention éventuelle d’autres professionnels
7) Définir la stratégie thérapeutique : Fonction du stade de la MRC
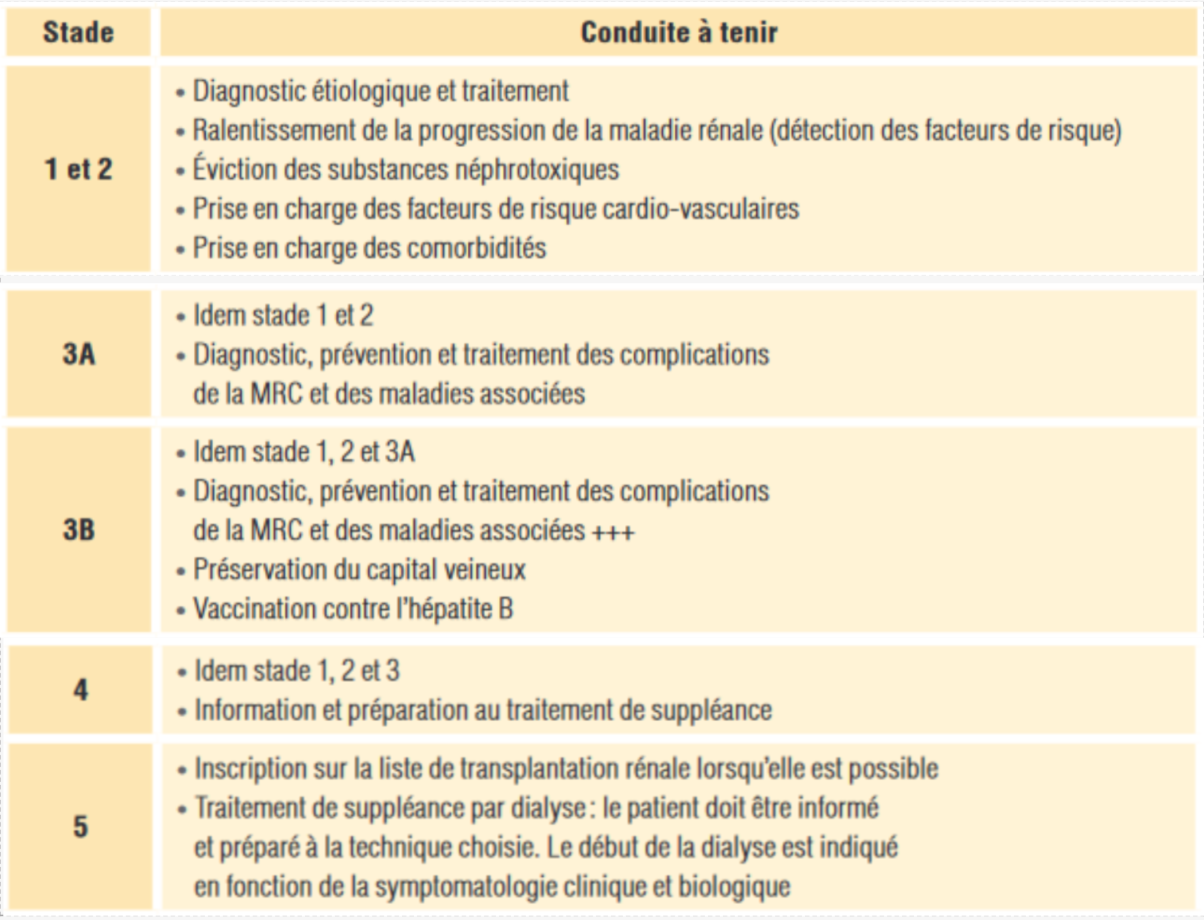


Le Dosage de l’urée sanguine n’est pas un dosage recommandé en systématique ( déremboursé en 2020) mais reste indiqué à partir du stade 3B pour le suivi du risque de dénutrition.
En conclusion, en présence de signes d’atteinte rénale :diminution du DFG, albuminurie, ( à rechercher 1x/an dans la population à risque), hématurie, leucocyturie, anomalie morphologique.
Il faut :
- Identifier une situation nécessitant une prise en charge spécialisée en urgence ou rapide.
- en dehors de ces situations, vérifier l’anomalie en répétant les tests dans les 3 mois qui suivent.
Ce qui permet de :
- Confirmer le diagnostic de maladie rénale chronique (les signes persistent pendant plus de 3 mois) et réaliser le bilan initial et le suivi.
- Référer au néphrologue en cas de doute sur la nature de la maladie rénale ou de nécessité d’examens spécialisés pour le diagnostic étiologique.
Réaliser le bilan initial et le suivi de la MRC consiste à :
- Interroger et Examiner le patient
- Prescrire le bilan paraclinique initial
- Définir le stade
- Evaluer la progressivité
- Evaluer le risque cardio vasculaire global
- Définir la stratégie thérapeutique
- Elaborer le programme personalisé de soins
Bilan paraclinique initial :
- Echographie rénale
- Dosage de la créatininémie (pour estimation du DFG)
- Bilan lipidique
- Glycémie à jeun
- Uricémie
- Vitamine D
- Hémogramme
- Na+,K+,Cl-,Bicarbonates
- + Bilan Urinaire : Cytologie + albuminuri
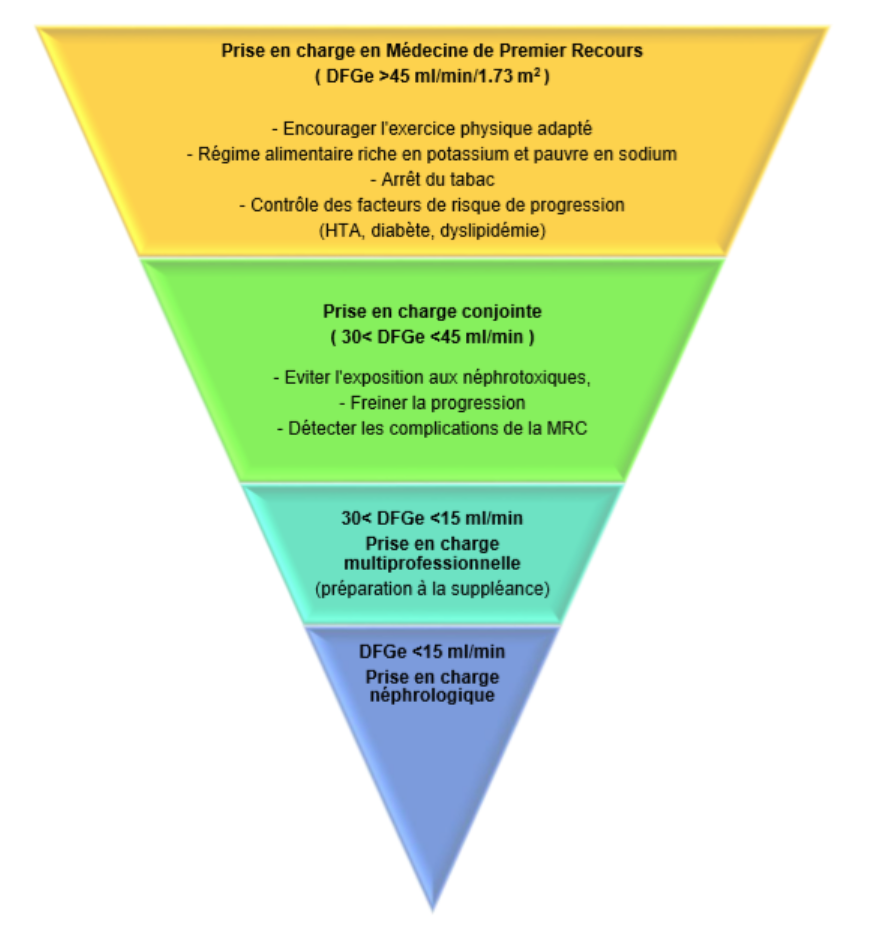
Critères de recours au spécialiste
Le recours au néphrologue est recommandé :
- En cas de doute sur la nature de la maladie rénale ou de nécessité d’examens spécialisés pour le diagnostic étiologique quelque soit le stade de la MRC
- Dans les situations d’urgences : Glomérulonéphrite rapidement progressive, insuffisance rénale aiguë, troubles ioniques menaçant.
- En cas de critère d’évolutivité rapide : Déclin annuel rapide du DFG, présence d’albuminurie, absence de contrôle de la pression artérielle
- A partir du stade 3B selon l’HAS : DFG<45 ml/min/1,73m²
- En cas de complications
Nécessité d’examen spécialisés, un avis néphrologique est nécessaire :
- pour l’indication d’une biopsie rénale,
- pour des explorations complémentaires fonctionnelles (tubulopathie, lithiase) ou morphologiques (kystes, dysplasie),
- des enquêtes génétiques,
- des examens biologiques ciblés (électrophorèse des protéines urinaires, une immunofixation des protéines urinaires, α galactosidase…).
Les recommandations du KDIGO sur les patients à adresser au néphrologue rejoignent celles de l’HAS avec quelques nuances sur :
L’adressage des patients présentant une MRC avec DFG estimé <30 ml/min/1,73m² soit les grades 4 et 5 (alors que la HAS préconise d'adresser les patients aux néphrologues dès le stade 3B) ;
- albuminurie significative de stade A3 (équivalent à une protéinurie supérieure ou égale à 500 mg/24h ou ratio protéinurie/créatininurie supérieur ou égal à 500 mg/g (ou 50mg/mmol) ;
- hématurie associée

Rôle du néphrologue :
- Aborder la suppléance, en réponse aux questions du patient, expliquer ses modalités, ses contraintes sur la qualité et l’espérance de vie.
- Etayer le programme personnalisé du patient au stade 4 ou au plus tard au stade 5 avec la planification d’une réunion de concertation pluridisciplinaire pour orientation en dialyse et évaluation prétransplantation
- Compléter le bilan initial

Examens complémentaires spécialisés réalisés suivant l’avis du néphrologue, lorsque le diagnostic étiologique est nécessaire :
- actes techniques : écho-Doppler des artères rénales, biopsie rénale ;
- examens biologiques : mesure du débit de filtration glomérulaire (contrôle du DFG estimé), électrophorèse des protéines sériques, exploration immunologique : complément et fractions C3, C4, recherche d’autoanticorps à visée étiologique : autoanticorps antinucléaires (ANA), antimembrane basale glomérulaire, anticytoplasme des polynucléaires neutrophiles (ANCA).
A Partir du Stade 3B sont inclus dans le co suivi médecin traitant/néphrologue
La préservation du capital veineux
La vaccination contre l’hépatite B
la mise en place de l’ALD selon les critères médicaux d’admission en vigueur revient au médecin traitant
Néphropathie chronique grave (ALD 19) : Sont concernées les atteintes glomérulaires, interstitielles, vasculaires, tubulaires ou les maladies héréditaires rénales, évoluant sur le mode chronique, en présence d'au moins un des critères de gravité suivants :
- Débit de filtration glomérulaire inférieur à 60 ml/min/1,73 m² x2 > 3 mois d'intervalle
- Protéinurie permanente supérieure, de façon durable, à 1 g/24 h/1,73 m de surface corporelle
- Troubles métaboliques phosphocalciques, acidobasiques, électrolytiques ou une anémie nécessitant un traitement et une surveillance biologique
- Uropathie nécessitant des soins et une surveillance continus.
- L'exonération initiale est accordée pour une durée de 5 ans, renouvelable.
THÉRAPIES FUTURES
« Epidemiology and prognostic signi¿cance of chronic kidney disease in the elderly—the Three-City prospective cohort study »
Nephrol Dial Transplant (2011):3286-3295.
Septembre 2014.
11. Haut Conseil pour l'Avenir de l'Assurance Maladie. Rapport annuel 2012. L'assurance maladie face à la crise : éléments d'analyse.
12. Fouquet Annie, Tregoat Jean Jacques, Sitruk Patricia. « L’impact des modes d’organisation sur la prise en charge du grand âge ».Inspection générale des affaires sociales. Rapport Mai2011.
13. HAS mars 2015. Note méthodologique et de synthèse documentaire, « Prendre en charge une personne âgée polypathologique en soins primaires ». Points clés, organisation des parcours.
14. Kidney Disease Improving Global Outcomes (KDIGO) 2013, Clinical Practice Guideline for the evaluation and management of Chronic Kidney disease, VOLUME 3 | ISSUE 1 | JANUARY 2013 http://www.kidney-international.org.
15. Go, Alan S, Glenn M Chertow, Dongjie Fan, Charles E McCulloch, and Chi-yuan Hsu. “Chronic Kidney Disease and the Risks of Death, Cardiovascular Events, and Hospitalization.” N Engl J Med (2004): 1296–1305.
16. Sylvie Legrain HAS 2006; « Consommation Médicamenteuse chez le Sujet Agé : Consommation, Prescription, Iatrogénie et Observance ».
17. Les consultations et visites des médecins généralistes Un essai de typologie. DREES. N° 315 • juin 2004.
18. Paul Jungers, Dominique Joly, Thao Nguyen-Khoa, Nadya Mothu, Nader Bassilios, JeanPierre Grünfeld. «Retard persistant au suivi néphrologique de l’insuffisance rénale chronique. Causes, conséquences et moyen d’amélioration ».
19.LA DÉMOGRAPHIE MÉDICALE EN RÉGION PROVENCE-ALPES CÔTE-D’AZUR Situationen 2013; Conseil National de l’Ordre des Médecins; Dr Jean-François RAULT.
20.ATLAS DE LA DÉMOGRAPHIE MÉDICALE EN France Situation en 2013; Conseil National de l’Ordre des Médecins; Dr Michel LEGMANN.
21.Introduction à la recherche qualitative Isabelle Aubin-Auger, Alain Mercier, Laurence Baumann, Anne-Marie Lehr-Drylewicz, Patrick Imbert, Laurent Letrilliart et le groupe de recherche universitaire qualitative médicale francophone : GROUM-F exercer 2008;84:142-5.
22.Stel,Vianda S, Moniek W M van de Luijtgaarden, Christoph Wanner, Kitty J Jager, and on behalf of the European renal registry investigators. « The 2008 ERA-EDTA Registry Annual Report-A Précis »Nephro Dial Transplant (2011.1-13.).
23.United States Renal Data Sytem, USRDS 2010 Annual Data Report: Atlas of end-stage renal disease in the United States. www.usrds.org.
24.Couchoud Cécile, Moranne Olivier, Luc Frimat, Michel Labeeuw, Vincent Allot, Stengel Bénédicte. « Associations Between Comorbidities, Treatment Choice and Outcome in the Elderly with End-Stage Renal Disease » Nephrol Dial Transplant (2007): 3246-3254.
25.Hemmelgarn, B R, J Zhang, B J Manns, M Tonelli, E Larsen, W A Ghali, D A Southern, K McLaughlin, G Mortis, and B F Culleton. «Progression of Kidney Dysfunction in the Community-dwelling Elderly» Kidney Int (2006):2155-2161.
26. Thèse Extermann Guillaume, Moranne Olivier; Les prescriptions médicamenteuses des médecins généralistes chez les patients de plus de 75 ans présentant une insuffisance rénale chronique sévère (2012).
27.Thèse Boudi Zoubir; Esnault Vincent; Dépistage et prise en charge de la maladie rénale chronique en soins primaires (2014).
28. O.Moranne, M.Daroux, F. Glowacki,C Gaxatte, J-B Beuscart, F.Puisieux, E.Boulanger.Vieillissement rénal, EMC Néphrologie, volume 10 n°2 avril 2013.
29.Stein and al. Age and the association of kidney measures with mortality and end-stage renal disease, JAMA 2012.
30.Simon SR, Gurwitz JH. Drug therapy in the elderly: improving quality and access. Clin Pharmacol Ther 2003;73(5):387-93.
31.Gurwitz JH, Rochon P. Improving the quality of medication use in elderly patients: a notso-simple prescription. Arch Intern Med 2002; 162(15):1670-2.
32.Tobias DE. Identifying potentially inappropriate drugs for geriatric patients: updating the beers list. More evidence for the treating systolic hypertension in the elderly. Hosp Pharm 2004;39(3):210-4.
33.Laurent S, Consoli S, Girerd X, Thomas D, Amouyel P, Levy A, et al. Causes of uncontrolled hypertension. DUO-HTA survey. Arch Mal Coeur Vaiss 2003;96(9):823-31.
34.S. Lewington, R. Clarke, N. Qizilbash, R. Peto, R. Collins Prospective studies collaboration. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies Lancet, 360 (2002), pp. 1903–1913.
35.Beckett NS, Peters R, Fletcher AE, et al; the HYVET Study Group. Treatment of Hypertension in Patients 80 Years of Age or Older. N Engl J Med 2008;358:1887-98.
36.ManciaG., LaurentS., Agabiti-RoseicE. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document J Hypertens 2009 ; 27 : 2121-2158.
37.HANON O, SEUX M-L, RIGAUD A-S. Hypertension artérielle chez le sujet âgé. EMC Médecine. oct 2004, vol. 1, n°5, p. 381-387.
38.MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomisedplacebo-controlledtrial. Lancet 2002; 360: 7-22.
39.Shepherd J, Blauw GJ, Murphy MB, Bollen EL, Buckley BM, Cobbe SM, Ford I, Gaw A, Hyland M, Jukema JW, Kamper AM, Macfarlane PW, Meinders AE, Norrie J,Packard CJ, Perry IJ, Stott DJ, Sweeney BJ, Twomey C, Westendorp RG. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet 2002; 360: 1623-30.
40.Prise en charge thérapeutique du patient dyslipidémique; Afssaps 2005
41.HolmanR.R., PaulS.K., BethelM.A., MatthewsD.R., NeilH.A. 10-Year follow-up of intensive glucose control in type 2diabetesN Engl J Med2008 ; 359 : 1577-1589].
42.Stratégie médicamenteuse du contrôle glycémique du diabète de type 2-HAS janvier 2013
43.Fried LF, Shlipak MG, Crump C, Bleyer AJ, Gottdiener JS, Kronmal RA et al. Renal Insufficiency as a predictor of cardiovascular outcomes and mortality in elderly individuls. J Am Coll Cardiol 2003;41:1364-72.
44.Winkelmayer WC, Owen W, Levin R, Avorn J. A propensity analysis of late versus early nephrologist referral and mortality on dialysis. J Am Soc Nephrol 2003; 14: 486–492
45.Cass and al, Delayed referral to a nephrologist : outcomes among patients who survive at least one year on dialyses. Med J Aust 2002; 177: 135-138
46.Kessler M, Frimat L, Panescu V, Brianc¸on S (EPIREL): results of a 2-year, prospective, community-based study. AmJ Kidney Dis 2003; 42: 474–485.
47.Frantzen L, Hannedouche T. L’insuffisance rénale, un facteur de risque cardiovasculaire. Rev Prat 2005;55:2249-5
48.Frimat, Siewe,Loos-ayav, Briançon, Kessler, Aubrège. Insuffisance rénale chronique: connaissances et perception par les médecins généralistes, Néphrol 2006 127-135.
49.Joly,Anglicheau, Guéry, Jungers. Octogénaires et dialyse; Actualités néphrologique
