Pathologie vasculaire digestive : ischémie mésentérique

INTRODUCTION/GÉNÉRALITÉ
- L’ischémie mésentérique aiguë (IMA) artérielle, ou ischémie intestinale aiguë, est une urgence vasculaire et intestinale.
- L’insuffisance de perfusion intestinale peut être occlusive ou non occlusive, aiguë ou chronique, artérielle ou veineuse, segmentaire ou étendue.1 1
- Il faut également distinguer les affections du grêle (ischémie mésentérique) et du côlon (colite ischémique). En effet, La confusion entre ischémie colique gauche et ischémie mésentérique est fréquente. Cependant, leur physiopathologie, leur traitement et leur pronostic diffèrent en tous points. L’ischémie du côlon droit, elle doit être considérée, a priori, comme une IMA.
- L'ischémie mésentérique aiguë (IMA)
- Elle conduit en quelques heures/jours à l’infarctus mésentérique et souvent au décès.
- Une souffrance intestinale aigue associée à une occlusion, complète ou incomplète (interruption ou diminution du flux sanguin splanchno-mésentérique), d’une seule artère digestive suffit au diagnostic d’IMA.
- Il s'agit essentiellement du territoire de l’artère mésentérique supérieure (AMS).
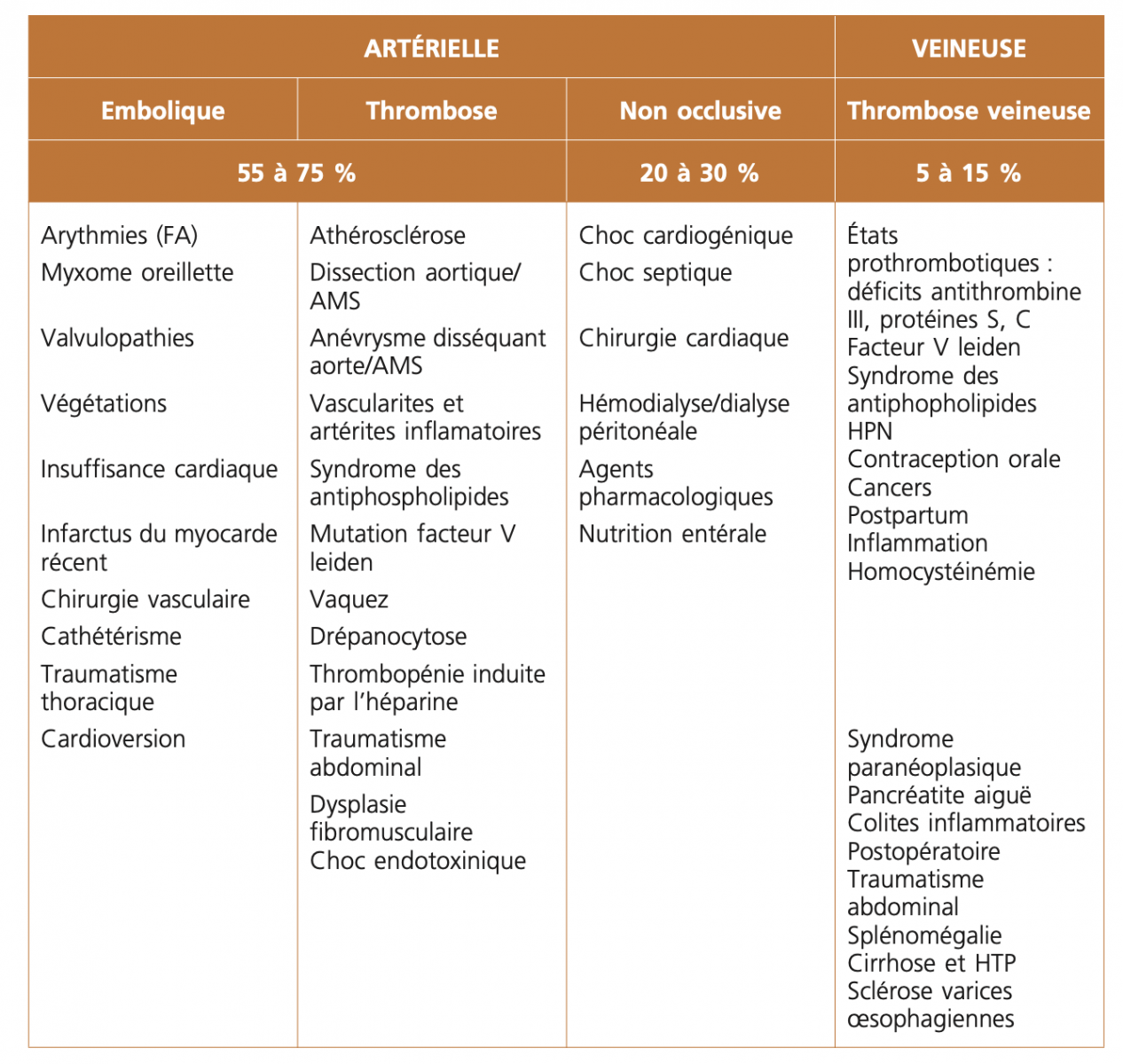
- L’ischémie mésentérique aiguë regroupe 4 formes distinctes : l’occlusion artérielle, par embole(s) (40%) ou thrombose (30%), la thrombose veineuse (10%) ou la forme « non occlusive » (20%).
- Elle peut compliquer une ischémie mésentérique chronique.
- L'ischémie mésentérique chronique (IMC) :
- Définie par l’existence d’un syndrome d’angor intestinal par sténose d’au moins deux des axes vasculaires artériels de l’aorte digestive sur trois (tronc cœliaque, artère mésentérique supérieure et inférieure).
- C'est une affection consécutive à une artérite oblitérante, athéromateuse (le plus fréquent), inflammatoire ou radique.
- Elle résulte de l'occlusion progressive des artères digestives.1 1
- Elle est potentiellement grave en raison du risque d'ischémie mésentérique aiguë.
- Les colites ischémiques gauches, correspondant à une ischémie dans le territoire de l’artère mésentérique inférieure (AMI).
- Les thromboses veineuses splanchniques (TVS) :
- Elles incluent les thromboses porto-mésentériques (thrombose de la veine porte et/ou de la veine mésentérique supérieure et/ou de la veine splénique) et les thromboses des veines hépatiques (Budd-Chiari).
- Elles sont une forme rare mais potentiellement grave de maladie thromboembolique veineuse.
- La thrombose veineuse mésentérique représente environ 10-15% des IMA et donne lieu à une ischémie intestinale dans environ 20% des cas. 1
- Son pronostic est meilleur que celui de l’IMA artérielle.
- Elles peuvent être favorisées par des causes locales ou systémiques.
Anatomie
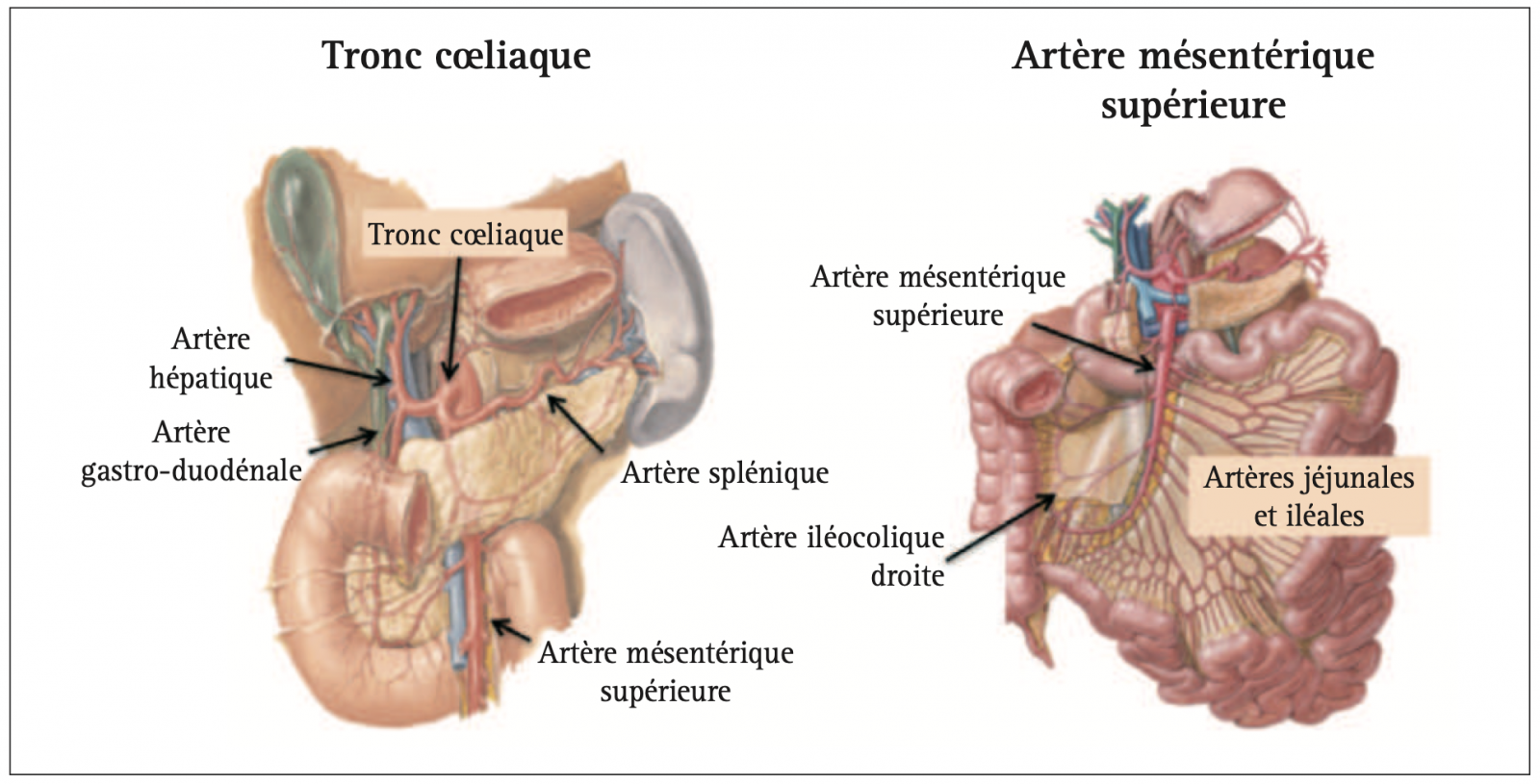
A) Vascularisation artérielle splanchnique
1) Les 3 principales artères digestives, branches antérieures de l’aorte sont, de haut en bas :
- Le tronc cœliaque (TC) :
- Vascularise les viscères : le foie, l’estomac, le bloc duodénopancréatique, les premiers centimètres du jéjunum et la rate.
- Il naît en regard du corps vertébral de T12- L1, juste en dessous de l’émergence diaphragmatique de l’aorte, sur sa face antérieure.
- Il est court (1,25 cm) et se dirige légèrement vers le bas avant de se diviser en trois branches.
- L’artère mésentérique supérieure (AMS) :
- Vascularise tout l’intestin grêle, la valvule iléocæcale et le colon droit.
- Naît 1 à 2 cm en dessous du tronc coeliaque, en regard de L1 se dirige vers le bas et la droite sur environ 25 cm de long pour se terminer au niveau du caecum en donnant l’artère iléo colique.
- L’artère mésentérique inférieure (AMI)
- Vascularise le colon depuis l’angle droit jusqu’à la charnière recto-sigmoïdienne (côlon transverse et côlon gauche).
- Le plus petit vaisseau mésentérique, naît 5 à 6 cm en dessous de l’artère mésentérique supérieure.1
Il est fréquent qu’une atteinte tronculaire proximale de cette AMS entraîne une souffrance intestinale étendue, alors qu’une atteinte distale, par exemple de l’artère iléo-cæco-appendiculaire, est associée à une atteinte segmentaire iléocæcale.

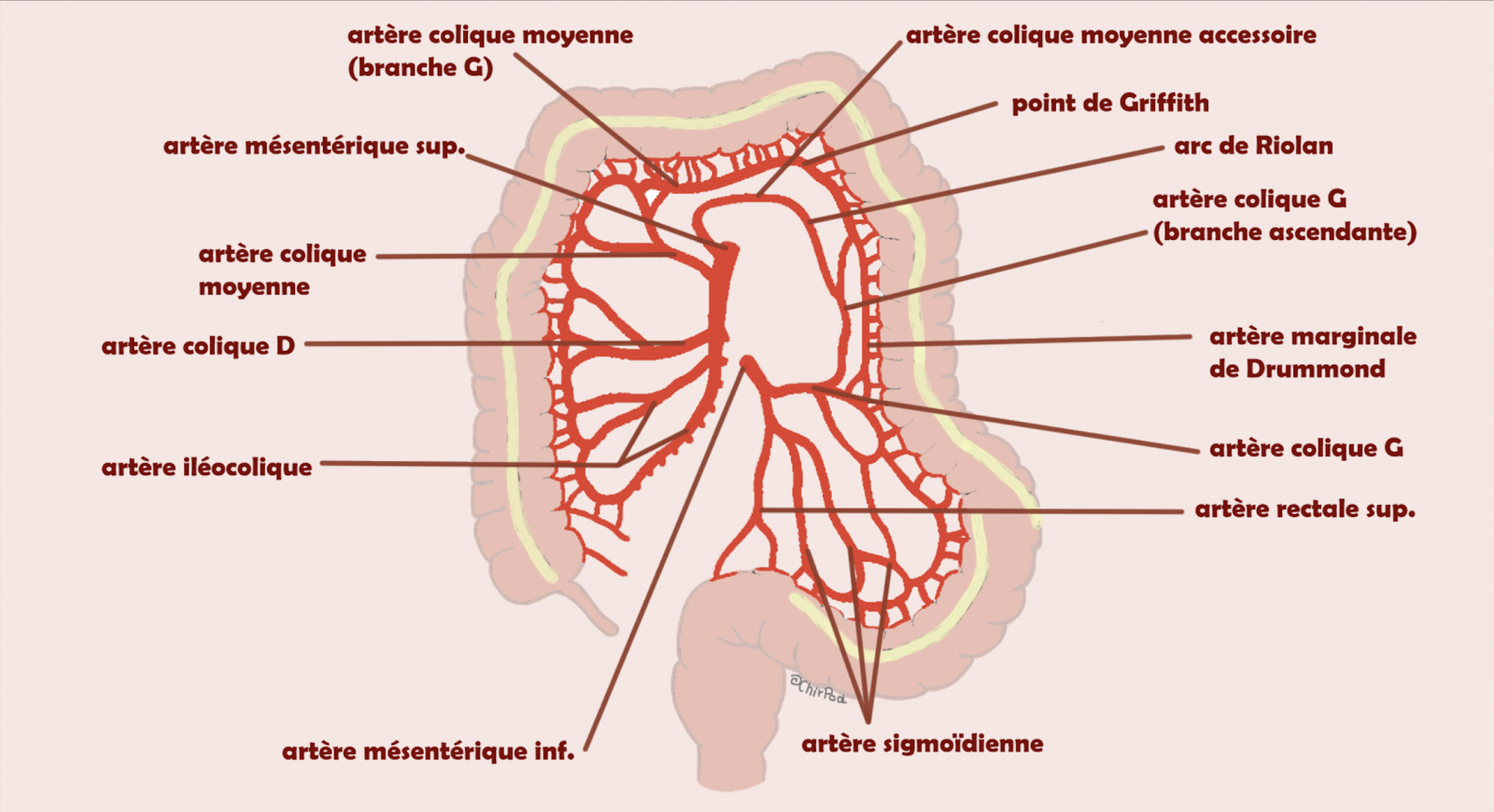
2) Collatéralités
Il existe de nombreuses variantes anatomiques et d’importantes collatérales afin de protéger le circuit digestif de l’ischémie intestinale :
- Les deux tiers inférieurs du rectum sont vascularisés par l’artère rectale moyenne, branche de l’artère iliaque interne.
- L’anus et la marge anale sont vascularisés par l’artère rectale inférieure, branche de l’artère honteuse interne.
- L’AMS donne deux branches : l’artère iléo-colique et l’artère colique supérieure droite, et l’AMI fournit l’artère colique gauche supérieure et le tronc des artères sigmoïdiennes. Ces artères forment des arcades bordantes : c’est ainsi que la vascularisation mésentérique est formée de plusieurs circuits ou réseaux couplés en série et en parallèle, ce qui permet théoriquement des suppléances en cas d’obstruction (complète ou incomplète) en différents points de ces réseaux. Ces arcades font du côlon un organe peu sensible à l’ischémie.
Cependant, malgré ces collatérales, il existe des zones dites critiques, plus sensibles à un bas débit :
- L’arcade de Riolan est parfois grêle, voire absente au niveau de l’angle gauche : il s’agit du point de Griffiths.
- L’arcade bordante est inconstante entre le sigmoïde et le haut rectum et ce point faible est appelé point de Südek = la jonction recto sigmoïdienne
En cas de défaillance vasculaire, l’atteinte colique est étroitement corrélée à la fonctionnalité des réseaux de suppléance. En cas de défaillance de l’AMI, le côlon descendant est épargné si l’arcade de Riolan est fonctionnelle alors que le sigmoïde est plus sensible car la suppléance vasculaire issue des artères iliaques internes est inconstante.1 1
L’ischémie mésentérique aiguë est l’expression d’une insuffisance de perfusion intestinale dans un territoire artériel majoritairement dominé par l’artère mésentérique supérieure, mais où les autres axes (tronc cœliaque et artère mésentérique inférieure) jouent des rôles secondaires et néanmoins non négligeables, par l’intermédiaire de réseaux anastomotiques variables. 1
3) La microcirculation
- La circulation splanchnique reçoit environ 25% du débit cardiaque (35% en post prandial) pour seulement 5% du poids du corps. Ce débit est uniformément réparti entre le tronc coeliaque et l’artère mésentérique supérieure (≈ 700 mL/min chez l’adulte) et à moindre degré l’artère mésentérique inférieure. La vascularisation spécifique de l’intestin grêle et du colon représente 75% de ce débit, soit respectivement environ 40 et 20 mL/min/100g de tissus.
- Par ailleurs, la distribution du flux sanguin dans la paroi intestinale n’est pas uniforme, 70% du débit mésentérique étant dédié à la muqueuse du fait d’une activité métabolique intense, 5% à la sous muqueuse et environ 25% à la musculeuse et à la séreuse.1
- La vascularisation des villosités intestinales est très particulière : chaque villosité intestinale contient une artériole centrale qui la traverse jusqu’à son sommet et se divise en réseau capillaire dense qui redescend le long de l’artériole pour confluer vers les veinules post capillaires. Ce système favorise la création d’un contre-courant artério-veineux à l’origine d’un gradient de concentration en oxygène entre la base et le sommet des villositées, les niveaux de pression partielle en oxygène étant les plus bas au sommet, de l’ordre de 10 mmHg. Ceci favorise l’hypoxie muqueuse lors d’une diminution des apports en O2, secondaire à une occlusion artérielle, un état de choc, ou encore à des désordres de la régulation microcirculatoire même si le débit sanguin est alors préférentiellement redistribué sur la muqueuse intestinale. Ceci explique entre autres pourquoi les lésions initiales siègent typiquement au sommet des villosités intestinales car plus sensible à l’ischémie.1 1
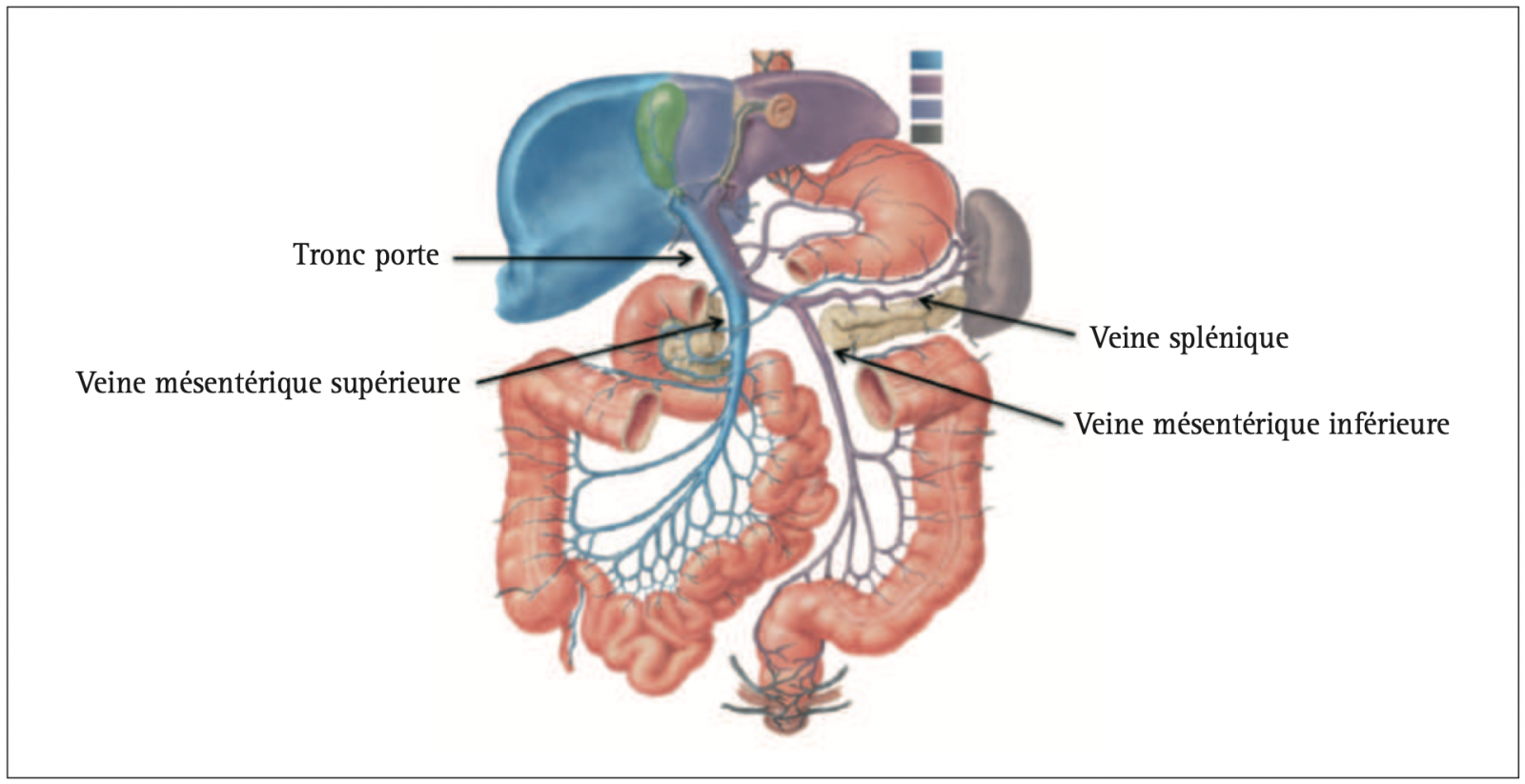
B) Vascularisation veineuse splanchnique
- En ce qui concerne le retour veineux, la veine mésentérique inférieure rejoint la veine splénique et l’ensemble conflue vers la veine mésentérique supérieure pour former le tronc porte.
PHYSIOPATHOLOGIE
A) Ischémie mésentérique aiguë
- L’ischémie mésentérique est la conséquence d’une interruption ou d’une diminution du flux sanguin splanchno-mésentérique. Elle peut être artérielle ou veineuse, aiguë ou chronique, occlusive ou non occlusive.
- L’ischémie mésentérique a une physiopathologie multi-étapes qui explique son évolution clinique inexorable en l’absence de traitement, depuis la douleur abdominale aiguë jusqu’à la nécrose intestinale étendue, la défaillance d’organes et le décès.
1) Seuil critique de délivrance en oxygène
- Quand le débit sanguin à destination digestive baisse en-dessous de 50 % du débit basal (le seuil critique de délivrance en O2), les cellules de la muqueuse et de la sous-muqueuse basculent vers une glycolyse anaérobie entraînant la production de lactates.
- Or, dans la plupart des cas d’ischémie splanchnique, les taux de lactates artériels vont rester normaux, en dépit d’une augmentation de la production de lactates par l’intestin.
- Cette dissociation tient en fait aux capacités hépatiques de métabolisation des lactates. Ainsi, l’acidose lactique systémique, signe de gravité classique de l’IMA, est un phénomène tardif, qui témoigne d’une ischémie sévère, transmurale et souvent nécrotique de l’intestin.1
2) Altération muqueuses intestinales et activation de l’immunité innée
- L’ischémie intestinale va être responsable d’une augmentation de la perméabilité épithéliale et d’une transocation bactérienne/endotoxines.
- Quand l’hypoxie, l’acidose régionale et la perméabilité épithéliale s’aggravent, de larges surfaces sous-muqueuses intestinales interagissent avec une charge antigénique bactérienne massive, stimulant l’immunité innée et les voies locales/systémiques inflammatoires telles que TLR, NF-KB ou TNF.1 1
- Les modèles animaux d’IMA, par occlusion de l’AMS, traités par un remplissage vasculaire et une décontamination antibiotique orale survivent plus longtemps que les contrôles ou les animaux recevant des antibiotiques IV.1
- Plus récemment, une méta-analyse et plusieurs essais randomisés contrôlés ont montré, chez les patients de réanimation, qu’une décontamination digestive orale/IV était associée à moins de défaillances d’organes, de bactériémies et de détresses respiratoires, confirmant le rôle délétère de la translocation bactérienne.1
- Après activation des voies inflammatoires régionales, un véritable emballement peut survenir avec nécrose irréversible de l’intestin, péritonite, généralisation de l’inflammation, sepsis, défaillance d’organes.
- Les lésions endothéliales vont être responsables d’une consommation plaquettaire et d’une activation de la fibrinolyse à l’origine de syndromes hémorragiques, notamment péritonéaux. Ainsi, les manifestations hémorragiques pré-, per- et postopératoires qui sont fréquemment observées sont précisément les témoins de la persistance de l'ischémie.
3) Occlusion vasculaire
- En cas d’occlusion artérielle, aiguë ou chronique, la demande métabolique du tissu dépasse l’apport en oxygène et les lésions d’ischémie se développent initialement à partir de la muqueuse et de la sous-muqueuse puis s’étendent en profondeur. Soixante-dix pour cent du débit intestinal étant destiné à la vascularisation de la muqueuse et de la sous-muqueuse intestinales, ces zones sont les premières à présenter des signes d’ischémie en cas d’occlusion artérielle. À mesure que l’occlusion se poursuit, la nécrose devient transmurale puis gangréneuse, conduisant au décès du patient en l’absence d’une résection intestinale urgente. Ainsi, lorsqu’une artère mésentérique (artère mésentérique supérieure le plus souvent) est occluse, l’ischémie devient rapidement transmurale/gangréneuse, tandis qu’une occlusion d’artérioles intramurales conduit à une ischémie intramurale muqueuse/sous-muqueuse. Il faut savoir cependant que les besoins métaboliques et en oxygène dépendent de plusieurs facteurs dont l’état hémodynamique général, le degré d’athérosclérose, l’importance de la circulation collatérale et de mécanismes complexes de régulation de la vasomotricité.1
4) La thrombose veineuse mésentérique (± portale)
- Elle peut survenir sur foie cirrhotique ou non.
- L’ischémie mésentérique résulte de l’extension du thrombus vers les veines mésentériques et les arcades veineuses mésentériques. Les arcades veineuses mésentériques fonctionnent en effet comme une circulation collatérale drainant le flux sanguin intestinal vers les territoires adjacents non thrombosés.
- Quand l’ischémie se prolonge au-delà de plusieurs jours, un infarctus intestinal peut survenir.
- En aval de la thrombose de la veine porte, les conséquences hépatiques sont peu marquées. Les signes clinique et biologique de souffrance hépatique sont absents ou transitoires.
- Des phénomènes de compensation naturelle expliquent pourquoi l’interruption du flux portal a peu de conséquence clinique. Un premier mécanisme compensatoire est la vasodilatation immédiate de l’artère hépatique en réponse à une diminution du flux veineux portal (arterial « buffer » response). Le second mécanisme compensatoire est le développement rapide de veines collatérales porto-portes, ou cavernome portal. Ces veines collatérales deviennent visibles quelques jours après la thrombose.
- L’infarcissement intestinal secondaire à une thrombose mésentérique pourrait être favorisé par un vasospasme artériel et/ou des facteurs de risque d’athérosclérose.1 1
4) Vasospasme artériel
- Dans les situations de bas débit, mais également en cas d’occlusion vasculaire, la vasoconstriction splanchnique est un phénomène précoce et profond, qui peut conduire à lui seul à une diminution du débit sanguin sous le seuil critique de 50 % à partir duquel les lésions d’ischémies vont se constituer.1 1
- L’ischémie splanchnique se développe ainsi bien avant que ne survienne l’instabilité hémodynamique. Cette vasoconstriction splanchnique peut être déclenchée à l’occasion d’états de choc, incluant les hémorragies, les sepsis, les hypovolémies ou les défaillance cardiogéniques mais aussi lors de certains traitements, de prise de cocaïne ou d’exercices intenses.1
- Elle est corrélée à la mortalité dans la pancréatite aiguë grave, les traumatismes, le postopératoire, le sepsis ou les hémorragies.1 1
- L’occlusion vasculaire conduit à une hypoperfusion splanchno-mésentérique, une activation du système rénine-angiotensine-aldostérone et une vasoconstriction digestive. Ce vasospasme est le plus souvent présent quel que soit le mécanisme de l’ischémie artérielle et persiste même après la levée de l’obstacle.1 1
B) Ischémie mésentérique chronique
- Selon la règle de Mikkelsen 1, la lésion de deux des trois artères viscérales est la condition nécessaire pour l'apparition de symptômes d'IMC compte tenu de la richesse du réseau collatéral digestif .
- Néanmoins, l'IMC peut se développer en présence de lésion isolée de l'artère mésentérique supérieure (AMS) si le réseau collatéral est insuffisant.
- Une lésion unique du tronc cœliaque (TC) ou de l'artère mésentérique inférieure (AMI) est généralement bien tolérée, alors qu'une occlusion ou une sténose de l'AMS associée à une collatéralité insuffisante peut entraîner des symptômes d'IMC.
ÉPIDÉMIOLOGIE
- La pathologie occlusive chronique des artères viscérales est plus fréquente que l'ischémie mésentérique aiguë (IMA).
-
Il s’agit d’une maladie dont l’incidence augmente ces dernières années, essentiellement en raison du nombre croissant de patients âgés et/ou atteints de maladies cardio-vasculaires évoluées ; elle représente environ 1/1000 hospitalisations et 1 à 2/100 hospitalisations pour douleurs abdominales.1 1 1 1 1
-
Dans sa forme aiguë, il s’agit d’une urgence vitale, le plus souvent chirurgicale, dont le pronostic reste sombre avec une mortalité élevée, de 50 à 95% selon les séries et l’origine de l’ischémie.1 1
- L'incidence précise de l'IMC est difficile à évaluer ; elle survient classiquement vers la 6ème décennie et s'associe souvent à d'autres symptômes liés à l'athérosclérose. Dans la littérature, les lésions associées du TC et de l'AMS sont présentes dans 25 % des cas d'ischémie digestive (extrêmes de 10-50 %) et les lésions des trois artères digestives sont retrouvées chez 55 % des patients (extrêmes de 10 à 85 %).
FACTEURS DE RISQUES
A) Ischémie mésentérique aiguë
- Facteurs de risques de thrombose, d’athérome ou de cardiopathie
- Cardiopathie ischémique, emboligène, arythmogène
- Tabac, HTA, diabète, dyslipidémie, athérosclérose
- Surpoids, antécédents thromboemboliques (fausses couches, phlébites..), contraception oestroprogestative, thrombophilie
- Traitement vasoconstricteur ou consommation de cocaïne
B) Ischémie mésentérique chronique
Elle survient préférentiellement chez des patients âgés avec terrain cardiovasculaire.
EXAMEN CLINIQUE
A) Ischémie mésentérique aiguë
1) La douleur abdominale, premier symptôme :
- Peut être aiguë et inaugurale ou succéder à une période plus ou moins longue d'angor mésentérique (douleurs postprandiales, peur alimentaire, perte de poids).
- Diffuse rapidement à l'ensemble de l'abdomen
- Est d'intensité croissante, rapidement très intense (requérant un morphinique), sans répit.
- Le début de la douleur aiguë doit être considéré comme le signal du compte à rebours conduisant, sans traitement, à la nécrose intestinale étendue et au décès.
- A ce stade il existe une dissociation entre son intensité et la pauvreté de l’examen abdominale.
- Il peut exister une distension intestinale progressive et des vomissements.
- Tardivement, la douleur s'associe à une fièvre, une défense, puis une contracture abdominale dans un contexte de Systemic Inflammatory Response Syndrome (SIRS) ou d'état de choc.1 1
2) Formes précoces et formes tardives d’IMA
Deux formes cliniques, précoces et tardives, ont été décrites, corrélées au pronostic de l’IMA (résection, longueur de la résection, durée de séjour en réanimation) :1
a) IMA précoce =Syndrome ischémique aigu mésentérique (SIAM) réversible :
- Stade de l'ischémie réversible
- Le patient présente des douleurs abdominales importantes, une selle précoce avec hyperpéristaltisme intestinal
- Signes négatifs : Absence de fièvre, abdomen plat, absence de défaillance hémodynamique, respiratoire, rénale, hématologique ou digestive
- Les patients ne rapporte pas toujours d’antécédent cardiovasculaire.
- Les vomissements, une diarrhée, une hémorragie digestive (ulcérations muqueuses), une distension abdominale avec intolérance digestive sont inconstants.
- Biologiquement il existe un syndrome inflammatoire (hyperleucocytose, CRP) et les lactates sont encore normaux.
- Devant un tel tableau le patient est trop souvent renvoyé à son domicile ou couché dans les étages, le temps que surviennent les complications.
b) IMA tardive : Infarctus mésentérique constitué
-
Après plusieurs heures d’évolution, la douleur s’associe à des symptômes qui témoignent de la sévérité de l’atteinte ischémique.1 C’est à ce stade que l’évolution devient dramatique et que le risque de mortalité est le plus grand. Ceux qui survivent ont le plus souvent un syndrome de grêle ultra-court nécessitant une prise en charge spécialisée et une nutrition parentérale de longue durée.1 1
- Au stade d’infarctus constitué, la douleur devient permanente, exacerbée lors de paroxysmes de plus en plus rares.
- La symptomatologie s’enrichit de vomissements abondants, fécaloïdes et à l’exacerbation initiale des bruits hydroaériques, succède un météorisme avec défense et silence auscultatoire, stigmates d'un syndrome occlusif intestinal.
- Suspicion de complication (péritonite, perforation, nécrose)
- Altération massive de l’état général : fièvre ou hypothermie, jusqu’à état de choc avec défaillance multiviscérale (respiratoire, hémodynamique, rénale, acido-basique, hématologique)
- A ce stade les lactates sont élevées, témoignant d’une ischémie/nécrose transmurale.
3) IMA veineuse et non occlusive
- La symptomatologie clinique de la TVM est moins bruyante et d’installation plus longue. 1 1 1 La douleur abdominale intense, sans spécificité topographique, parfois intermittente depuis plusieurs semaines, liée à l’extension progressive du thrombus est évocatrice. Parallèlement coexistent anorexie, nausées, vomissements et diarrhée liquidienne parfois sanglante.
- Dans l’IMA non occlusive la douleur abdominale est moins nette, voire absente et souvent polluée par la coexistence d’une pathologie aiguë intercurrente facteur de retard diagnostic. L’IMA doit être évoquée même quand la douleur manque ou est inévaluable (sédation) chez un patient ayant des facteurs de risque et qui développe en post-opératoire météorisme, intolérance nutritionnelle, diarrhée, hémorragie digestive basse, acidose, bactériémie ou lorsque apparaît une défaillance polyviscérale.1
B) Ischémie mésentérique chronique
Triade diagnostique :
- Douleurs abdominales postprandiales (15-30 minutes après le repas, à type de crampes, épigastriques ou péri-ombilicales, qui vont disparaître en quelques heures). La douleur peut être calmée par la trinitrine.
-
L'intensité et la durée de la douleur sont corrélées à la quantité et à la teneur calorique du repas et au degré d'obstruction artérielle. Au stade précoce des lésions, seuls les repas abondants déclenchent la douleur qui devient plus fréquente avec l'ingestion de faibles quantités d'aliments lorsque les lésions artérielles sont plus importantes.
- Lorsque les douleurs abdominales deviennent permanentes, on parle de syndrome de menace mésentérique annonciateur d'un infarctus mésentérique.
-
- Amaigrissement (secondaire à la douleur entraînanr un fractionnement des repas et une réduction des apports). Une peur de s'alimenter en raison des douleurs (sitophobie) est souvent présente.
- Stéatorrhée (par atrophie villositaire intestinale)
- Les autres symptômes retrouvés sont une diarrhée (35 %), des nausées ou vomissements (30 %) et une constipation (20 %).
- L'auscultation peut retrouver un souffle épigastrique (très théorique).
EXAMENS COMPLÉMENTAIRES
A) Ischémie mésentérique aiguë
1) Biologie
La biologie reste décevante en l’absence de marqueur précoce d’ischémie du mésentère.
Dans la forme précoce : La normalité des lactates n’exclut pas le diagnostic et doit au contraire conduire à un traitement urgent.1
L’acidose métabolique avec trou anionique élevé et présence de lactates est en faveur d’une ischémie sévère avec nécrose devant un tableau abdominal aigu mais ce signe reste peu spécifique et il est tardif.1
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
ÉTIOLOGIE
A) Causes des ischémies mésentériques aiguës
1) L’IMA occlusive concerne l’occlusion d’un ou plusieurs vaisseaux digestifs, le plus souvent l’artère mésentérique supérieure.
a) Cause embolique :
- L'embolie reste la cause la plus fréquente de l'IMA et elle est retrouvée dans 50 % des cas.
- La plupart des emboles sont d'origine cardiaque : Anévrismes ventriculaires, troubles du rythme, pathologie ou prothèse des valves mitro-aortiques peuvent favoriser la formation de thrombi et leur embolie périphérique.
- Les autres sources d'embolies sont les pathologies anévrismales et les lésions athéromateuses de l'aorte ou les embolies iatrogènes au cours des procédures endovasculaires.
- L'IMA doit être suspectée chez les patients qui ont une pathologie cardiaque emboligène et qui présentent une douleur abdominale brutale associée à une diarrhée.
b) Thrombose
- L’ischémie thrombotique se développe au sein d’artères digestives pathologiques (sténose, athérome, artérite).
- La thrombose athéromateuse des artères viscérales est retrouvée dans 25 % des cas d'IMA et survient au cours des états de bas débit ou d'extension de la plaque d'athérome qui réduit le diamètre de l'artère. La gravité de l’ischémie dépend dans ce cas de l’absence de collatéralité et de sa survenue chez un patient dénutri, notamment lorsqu’elle succède à une IMC. En cas d’importantes collatérales, le risque de nécrose est plus faible.
- Parfois la thrombose survient sur une vascularite dont les principales sont la péri-artérite noueuse, le purpura rhumatoide, la maladie de Wegener, Churg et Strauss, la polyangéite microscopique, le syndrome hyperéosinophilique, la maladie de Takayasu(18).
- Une artérite radique, une dissection/anévrysme artérielle ou une complication chirurgicale peuvent être en cause.
- Un syndrome des anti-phospholipides, une thrombophilie ou une hypercoagulabilité peuvent être également en cause.1
2) IMA non occlusive et syndrome d’hypoperfusion intestinale (SHI)
Elle est liée à une hypoperfusion des artères mésentériques. Le risque de survenue augmente avec l’âge. Son origine est multifactorielle :
- La thrombose veineuse mésentérique représente environ 15% des IMA et donne lieu à une ischémie intestinale dans environ 20% des cas.
- Un infarcissement intestinal peut survenir en cas de baisse relative du débit artériel (sepsis, hémorragie, hypovolémie) ou de vasoconstriction artérielle.
- Une cause locale est identifiée dans environ 30% des cas, et une cause générale dans 70% des cas et doivent toujours être recherchées :
- Les causes locales sont : cancer, inflammation locorégionale (pancréatite, angiocholite, sigmoïdite, cholécystite, MICI, CMV, chirurgie), cirrhose.
- Les causes générales sont l’hémoglobinurie paroxystique nocturne, les syndromes myéloproliferatifs, le syndrome des anti-phospholipides, la maladie de Behçet, la maladie cœliaque et les thrombophilies héréditaires.1
- Les interactions pharmacologiques de patients souffrant de multipathologies nécessitant de nombreux médicaments qui sont des cofacteurs de vasoconstriction mésentérique :
- Les digitaliques, les alcaloïdes, les dérivés de l’ergot de seigle et la cocaïne et ses dérivés constituent un risque additionnel de développer un SHI, et doivent être recherchés en particulier chez les sujets jeunes (cocaïne).1
- L’association de traitements cardiaques et de furosémide chez les insuffisants cardiaques entraîne une diminution de la perfusion mésentérique par hyperaldostéronisme (secondaire à l’hypovolémie).
- Une pathologie cardiaque, avec bas débit conduisant à une vasoconstriction artérielle mésentérique, elle même secondaire à une activation sympathique.1
- Les autres causes de vasoconstriction mésentérique sont les états de choc quels qu’ils soient, la déshydratation, la dialyse, la chirurgie cardiaque ou abdominale majeure, les doses importantes de vasoconstricteurs sans prise en compte de l’hémodynamique splanchno-mésentérique.1 1
B) Causes des ischémies mésentériques chroniques
- L'athérosclérose est la cause la plus fréquente, elle représente 95 % des IMC.
- Les autres étiologies plus rares sont la dysplasie fibromusculaire, la dissection aortique et la dissection isolée des artères digestives, la neurofibromatose, le syndrome du ligament arqué et les artériopathies inflammatoires (maladie de Takayasu, mala-die de Behçet, maladie de Buerger...)
COMPLICATIONS
Votre texte ici
PRISE EN CHARGE THÉRAPEUTIQUE
Votre texte ici
ÉVOLUTION/PRONOSTIC
A) Ischémie mésentérique aiguë
- En l’absence de traitement, l’IMA conduit au décès dans près de 100 % des cas.
- Dans les formes traitées, sa mortalité historique est de l’ordre de 50 à 80 % dans la littérature. Ce pronostic sombre a nourri l’imaginaire de plusieurs générations de médecins. Déconstruire cet imaginaire et ancrer la réalité des résultats actuels des centres experts dans les représentations collectives sont un défi pédagogique immense. Il se jouera tant au niveau de la formation médicale initiale que dans la formation continue.
- Depuis la création de la Structure d’URgences Vasculaires Intestinales (SURVI), une prise en charge multidisciplinaire et multimodale, répondant à la physiopathologie de l’IMA et fondée sur la préservation intestinale, a permis de réduire drastiquement la mortalité à 20 %, soit une survie de 80 %.1
- La résection intestinale peut être évitée dans deux cas sur trois. 1
PRÉVENTION
Votre texte ici
SURVEILLANCE
Votre texte ici
CAS PARTICULIERS
Votre texte ici
THÉRAPIES FUTURES
Votre texte ici
