Tumeurs malignes de l'aorte et de ses branches

INTRODUCTION/GÉNÉRALITÉ
-
L'International Society for the Study of Vascular Anomalies distingue les malformations vasculaires des tumeurs vasculaires. Les premières sont une perturbation de la morphogenèse vasculaire au cours du développement embryonnaire sans prolifération cellulaire et les secondes une prolifération cellulaire manifeste.1 1
-
Les tumeurs vasculaires bénignes, angiomes et hémangiomes, regroupent plusieurs entités nosologiques avec une présentation clinique habituellement pédiatrique et dermatologique.
-
Les tumeurs à malignité intermédiaire, incertaine ou potentielle comme l'hémangio-endothéliome doivent être évoquées.
-
Les tumeurs à malignité avérée sont les plus préoccupantes. Leur rareté en rend l'étude difficile. Leurs symptômes sont souvent peu évocateurs comme une hypertension artérielle ou une claudication. Elles sont rares, représentant moins de 1 % de tous les sarcomes de l'adulte. Parmi ces tumeurs vasculaires malignes, celles qui affectent l'aorte sont les plus rares. Moins de 150 cas sont décrits depuis la première description en 1873 par Brodowski.1 1 1
HISTORIQUE
Votre texte ici
ANATOMOPATHOLOGIE
-
Le diagnostic relève le plus souvent de l'étude histologique d'une pièce de « thrombectomie », d'exérèse ou nécropsique d'aorte ou d'organes ou de tissus atteints par contiguïté ou métastase : poumon, foie, rachis, pancréas ou rein. 1
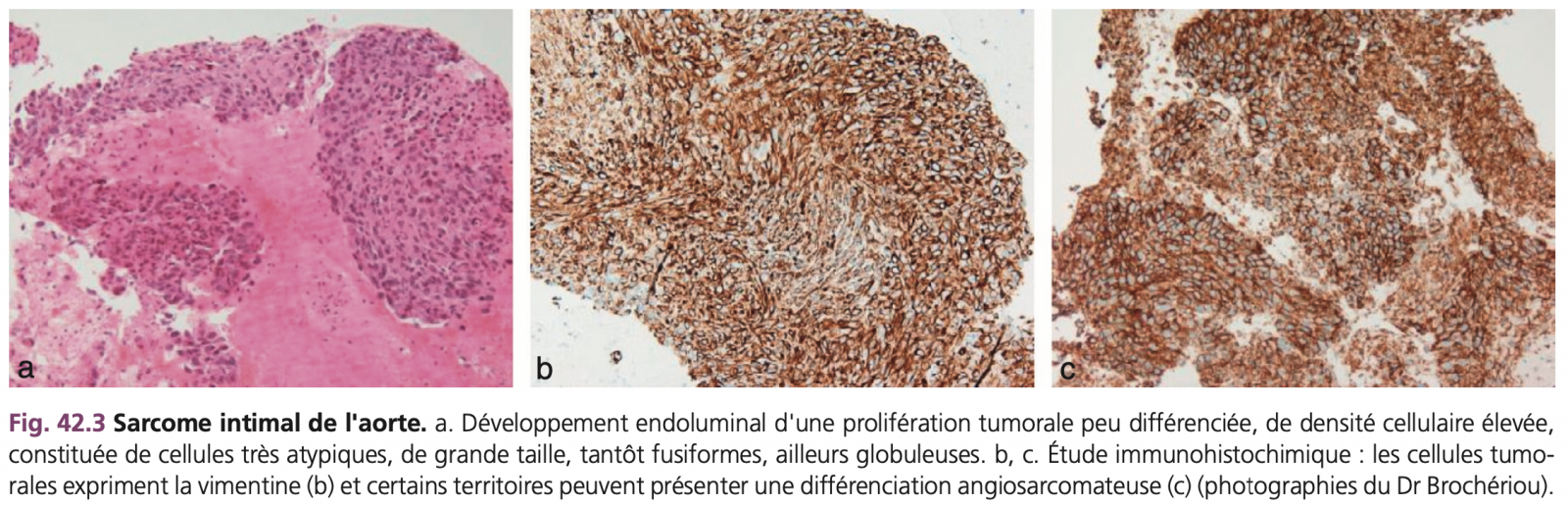
A) Sarcome intimal
-
Le sarcome intimal naît comme son nom l'indique dans l'intima et se développe dans la lumière. Il se développe en bourgeons luminaux irréguliers et friables convergeant en plaques, responsables d'embolies périphériques. La tumeur reste le plus souvent limitée à l'intima (Fig. 42.3a). Elle peut toutefois envahir la média et l'adventice.
-
Classée tumeur mésenchymateuse maligne par l'OMS,1 ce sarcome intimal est fait d'une prolifération peu différenciée de fibroblastes ou de myofibroblastes avec parfois quelques plages de différenciation évoquant un rhabdomyosarcome, un ostéosarcome ou un angiosarcome. La densité cellulaire est variable. Les cellules sont souvent très atypiques, de grande taille, tantôt fusiformes et disposées en courts faisceaux, ailleurs globuleuses (Fig. 42.3a). Les limites cytoplasmiques sont peu nettes, les noyaux sont monstrueux et nucléolés et le cytoplasme abondant et parfois clair. Les mitoses sont fréquentes. Ces cellules tumorales forment des nappes denses ou sont situées dans un stroma fibrohyalin ou œdémateux, modérément inflammatoire.
-
À l'étude immunohistochimique, les cellules tumorales expriment la vimentine (Fig. 42.3b). L'expression des marqueurs musculaires comme l'α-actine-musculaire lisse et la desmine est variable. Pour l'OMS, le sarcome intimal n'exprime habituellement pas les marqueurs vasculaires CD31, CD34 et facteur VIII. Toutefois ces anticorps peuvent marquer les plages à différenciation angiosarcomateuse (Fig. 42.3c).
-
L'origine cellulaire de ces sarcomes intimaux reste mystérieuse car les cellules de l'intima ont un fort poten- tiel de différenciation. En se basant sur des critères morphologiques, immunohistochimiques ou ultrastructuraux, une origine myofibroblastique ou endothéliale a été proposée.
-
L'étiologie de ces tumeurs est inconnue. Toutefois, une responsabilité des substituts vasculaires synthétiques, plus spécifiquement en dacron1 a été évoquée devant une survenue au contact de ces dispositifs.1
B) Angiosarcome
-
Certains facteurs associés sont suspectés : altérations génétiques acquises, irradiation, lymphœdème chronique post-chirurgical ou post-infectieux, fistule artérioveineuse, exposition au Thorotrast, aux insecticides, au chlorure de vinyle et angiomatoses comme le syndrome de Maffucci 1 1 1 1 1 1 1 1 1
-
Le diagnostic est exclusivement histologique. Les cellules expriment les spécificités morphologiques et fonctionnelles de l'endothélium normal. La tumeur est infiltrante, volontiers angiogénique avec des zones hémorragiques, microkystiques ou spongieuses. Elle est souvent entourée de vaisseaux dilatés correspondant à une zone tumorale bien différenciée. Les cellules ont un noyau volumineux, souvent hyperchromatique et convergent en papilles endoluminales. Parfois la différenciation est telle que seule l'évolution fait le diagnostic différentiel avec un hémangiome. À l'inverse, le diagnostic des formes les moins différenciées peut exiger de rechercher en immunohistochimie l'expression des marqueurs endothéliaux comme le CD34, le CD31 et le facteur VIII.
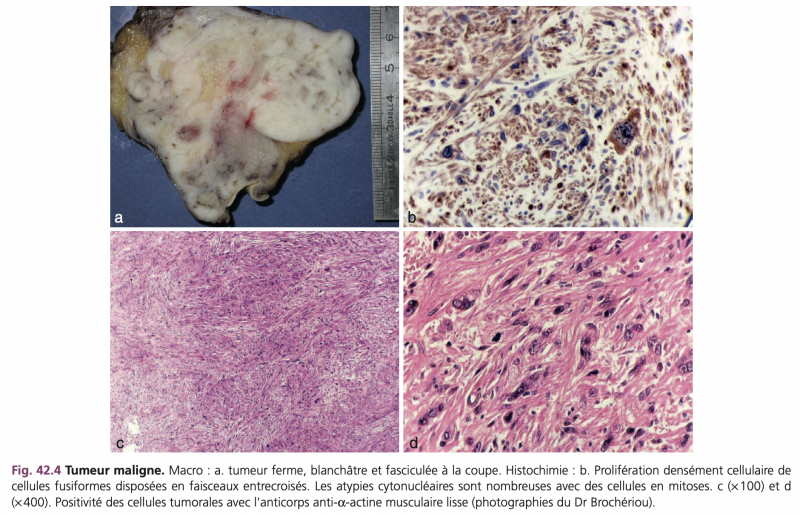
C) Léiomyosarcomes
-
Les léiomyosarcomes aortiques sont encore plus rares que ceux de la veine cave avec seulement environ 35 cas recensés.1
-
Il s'agit d'anomalies tumorale de la média, de couleur blanchâtre à grise, de consistance ferme voire dure et d'aspect fasciculé à la coupe.
-
Les tumeurs les plus volumineuses peuvent comporter des foyers de nécrose, des remaniements hémorragiques, des secteurs myxoïdes ou fibreux.
-
La cellularité est dense, faite de cellules fusiformes disposées en longs faisceaux. Les cellules tumorales ont des noyaux centraux à extrémités arrondies « en cigare » et un cytoplasme abondant, éosinophile, souvent d'aspect fibrillaire pouvant contenir une vacuole encochant le noyau. Les noyaux peuvent être irréguliers, polymorphes, plurilobés ou monstrueux (Fig. 42.4).
-
L'index mitotique constitue le meilleur critère de malignité ; cependant il est variable au sein d'une même tumeur. L'étude immunohistochimique peut aider au diagnostic (desmine et h-caldesmone).
D) Hémangio-endothéliomes
-
Les hémangio-endothéliomes épithélioïdes sont le type même des tumeurs vasculaires à malignité potentielle.1
-
Leur localisation aortique est très rare.
-
La lésion se présente comme une masse intravasculaire, pouvant en imposer pour un thrombus, constituée de cordons et de nids de cellules arrondies ou finement allongées au cytoplasme éosinophile justifiant cet adjectif d'épithélioïde.
CLASSIFICATION
A) Classification
Les tumeurs sont classées, selon leur siège, en tumeurs pariétales et en tumeurs luminales :
-
Les tumeurs pariétales se développent au sein de la paroi vasculaire et sont dans 90 % des cas des léiomyosarcomes et dans 10 % des cas des sarcomes moins différenciés, des chondrosarcomes ou des ostéosarcomes.
-
Les tumeurs luminales ont un point de départ intimal et sont représentées par le sarcome intimal et de rares angiosarcomes.
-
Cette dénomination indique le point de départ du développement de ces tumeurs et non leur origine cellulaire qui reste encore discutée.1
B) Localisation
-
Les localisations sont par ordre de fréquence : l'aorte thoracique descendante (35 %), l'aorte abdominale (27 %), l'aorte thoraco-abdominale (27 %), l'aorte ascendante et la crosse de l'aorte (11 %).1
-
Une extension par contiguïté aux organes de voisinage est rare et se voit le plus souvent au cours des sarcomes à développement mural ou envahissant les trois tuniques pariétales.
-
Des localisations secondaires sont trouvées chez 50 à 80 % des patients.1 1 1 Ces localisations secondaires peuvent être des métastases tissulaires (50 %), des embolies métastatiques (27 %) ou une combinaison des deux (24 %). Globalement, dans 46 % des cas, les métastases sont multiples ou associées à des embolies tumorales.
-
Les localisations tissulaires sont par ordre de fréquence : osseuses (27 %), pulmonaires (15 %), cutanées (9 %), rénales (7 %), surrénaliennes (7 %) et intestinales (7 %).1
-
Les embolies tumorales concernent préférentiellement les membres inférieurs (43 %), le tube digestif (32 %), le rein (20 %) et le cerveau (5 %).1
-
ÉPIDÉMIOLOGIE
Votre texte ici
FACTEURS DE RISQUES
Votre texte ici
EXAMEN CLINIQUE
-
Leur révélation tardive est caractéristique. En effet, les symptômes révélateurs sont le plus souvent ceux des localisations secondaires ou ceux liés à des phénomènes artériels thrombo-emboliques ou hémodynamiques.
-
La confusion initiale avec l'athérome est très fréquente. Il arrive même de façon non anecdotique que le diagnostic résulte de l'étude histologique d'un « thrombus artériel », parfois même en post-mortem.1
-
Il n'existe aucun symptôme spécifique. La prédominance est masculine (64 %), avec un âge moyen de 60 ans. Les signes généraux comme asthénie, amaigrissement ou fièvre sont rarement révélateurs.1
-
Les symptômes de mécanisme thrombo-embolique ou hémodynamique prédominent dans la littérature 1 1: ischémie aiguë d'un membre, hypertension artérielle rénovasculaire, claudication intermittente des membres inférieurs, infarctus ou ischémie digestive.
-
La révélation par un syndrome tumoral, masse palpable avec ou sans compression des structures voisines de voisinage, est bien plus rare.
-
La rupture ou la fistule dans un organe de voisinage (arbre bronchique, veine cave ou tube digestif) sont encore plus rares 1 1 1 1.
-
Les localisations intracardiaques peuvent être révélées par des accidents ischémiques cérébraux ou des membres supérieurs 1 ou même par un épanchement péricardique voire une tamponnade, une insuffisance cardiaque avec ou sans trouble de rythme.1
-
Un syndrome de pseudo-coarctation aortique avec hypertension isolée des membres supérieurs et une claudication des membres inférieurs est occasionnellement rapporté révélant une tumeur de l'aorte thoracique descendante.1
EXAMENS COMPLÉMENTAIRES
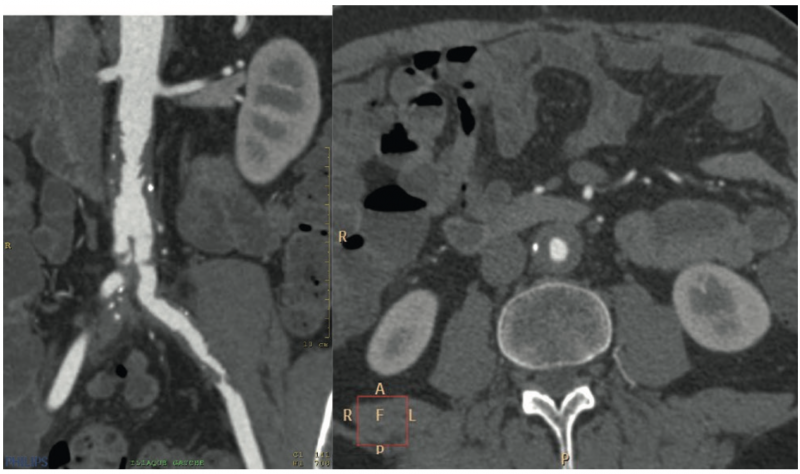
A) L'imagerie par résonance magnétique (angio-IRM) et l'angio- TDM
-
Ils vont permettre d'établir le diagnostic.
-
L'angio-TDM a pour avantages sa disponibilité et sa simplicité.
-
L'angio- IRM aurait un meilleur pouvoir discriminant que l'angio-TDM en ce qui concerne la très fréquente discussion différentielle avec l'athérome. Cependant, la grande diversité des séquences proposées fait nuancer cette proposition.
-
La tumeur primitive peut apparaître comme une anomalie morphologique de la paroi aortique avec bourgeonnement intra- ou exoluminal.1 1 1 Cela explique la fréquente confusion avec l'athérome bourgeonnant ou ses conséquences thrombo-emboliques. En angio-IRM, elle apparaît comme un hyposignal en T1 et un hypersignal en T2.1 1 Un rehaussement tumoral à l'injection de gadolinium permet souvent de distinguer les structures tumorales de l'environnement normal ou athéromateux.1 1
-
L'angio-IRM/TDM permettent de mesurer le volume tumoral et l'extension topographique à l'aorte et ses branches, éléments essentiels pour établir une stratégie chirurgicale éventuelle. Ils permettent aussi le diagnostic des localisations tumorales secondaires et des lésions ischémiques d'aval, hémodynamiques ou surtout thrombo-emboliques.
B) L'écho-Doppler artériel
-
Il est surtout utile à l'appréciation du retentissement artériel d'aval.
C) L'échographie cardiaque transœsophagienne
- Elle est très utile pour le diagnostic et l'évaluation des tumeurs intracardiaques, péricardiques, de la crosse et de l'aorte descendante.
D) L'artériographie préopératoire
-
Elle a été reléguée par l'angio-TDM et l'angio-IRM au rang des explorations tactiques chirurgicales.
-
Elle présente un risque d'embolie éventuellement métastatique d'autant plus important que la tumeur a un développement intimal.1
E) La tomographie par émission de positons au [18 F]-FDG
-
Elle n'a pas été spécifiquement évaluée.
-
Néanmoins, dans quelques cas de la littérature [4, 17–19], cet examen montre un hypermétabolisme, particulièrement utile pour faire la différence entre une manifestation thrombo-embolique banale et une métastase embolique.
F) Bilan d'extension
-
Il doit comprendre une scintigraphie osseuse, une tomodensitométrie thoracique, abdominale et pelvienne.
-
Une imagerie cérébrale peut être proposée en cas de lésion de l'aorte ascendante et de la crosse de l'aorte.
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
Votre texte ici
PRISE EN CHARGE THÉRAPEUTIQUE
A) Tumeurs à malignité avérée (angiosarcomes, hémangio-endothéliomes malins, léiomyosarcomes et sarcomes intimaux)
-
Les cas de survie à long terme sont exceptionnels et font suite à une exérèse carcinologique précoce et complète.
-
Les autres thérapeutiques comme la chimiothérapie, la radiothérapie et l'immunothérapie restent cantonnées à un rôle adjuvant ou palliatif.
1) Le traitement chirurgical comprends :
a) Exérèse de la tumeur
-
L'exérèse tumorale qui doit, de manière exhaustive, prélever les trois couches de la paroi artérielle dans tout le segment pathologique et toute extension intimale ou adventicielle présente.
-
Les sections artérielles doivent porter en zone macroscopiquement saine, avec des marges confortables, si possible de plusieurs centimètres.
-
La seule chance de survie est une exérèse carcinologique. Tout « clivage » passant au contact de la tumeur est donc voué à l'échec et doit donc être remplacé par un sacrifice radical emportant tout le pédicule et donc souvent l'organe concerné. Cette règle est évidemment moins évidente pour les tumeurs à malignité potentielle.
-
Dans le cas de l'aorte et de ses branches directes, la reconstruction artérielle est indispensable. Cette reconstruction utilise toutes les techniques disponibles, in situ ou extra-anatomiques. Sans rentrer dans les détails techniques, il faut mentionner ici que l'arsenal du chirurgien vasculaire est suffisamment étendu pour rendre les tumeurs « inextir- pables » exceptionnelles.
-
Les contre-indications à l'exérèse des tumeurs les plus proximales sont en général liées au terrain où à l'envahissement massif de structures vitales non substituables.
b) Traitement des complications hémodynamiques ou thrombo-emboliques.
-
Le traitement est implicite et souvent assuré par la reconstruction après exérèse.
-
Les complications thrombo-emboliques posent en plus le problème de leur potentiel disséminateur. Celui-ci est particulièrement évident pour les sarcomes intimaux dont les embolies constituent le mode le plus redoutable de propagation. Même pour les autres tumeurs malignes, le thrombus in situ et sa propagation embolique peuvent contenir des cellules à l'origine de métastases.
-
Cela fait insister sur le principe de l'examen histologique de toute pièce de thrombectomie ou d'embolectomie, même en dehors de tout contexte tumoral.
-
Quand ce contexte tumoral existe, tous les moyens doivent être mis en œuvre pour un confinement précoce de tout matériel endovasculaire au contact de la tumeur pour éviter une dissémination peropératoire. Cela est d'autant plus important que l'exérèse nécessite une assistance circulatoire ou a fortiori une circulation extra-corporelle totale.
-
Pour les tumeurs à malignité potentielle comme les hémangio-endothéliomes épithélioïdes, l'exérèse reste l'arme thérapeutique principale pour supprimer ou réduire le potentiel locorégional.
-
Toutefois, la radiothérapie isolée peut s'avérer utile pour atteindre un objectif similaire avec les tumeurs dont le traitement chirurgical est difficile ou dangereux. La surveillance à distance est essentielle et constitue finalement le seul élément pronostique.
ÉVOLUTION/PRONOSTIC
A) Généralités
-
Le pronostic des patients présentant une tumeur maligne de l'aorte est médiocre.
-
La majorité des patients décèdent dans les deux ans suivant le diagnostic en raison des localisations secondaires : la moyenne de survie des séries est de 14 à 27 mois.1 1 1 1 En méta-analyse, le taux de survie est de 11% à 3 ans et 8 % à 5 ans.1
-
Pour les patients ayant reçu un traitement chirurgical, la moyenne de survie est de 20 mois et la médiane de 10 mois ; le taux de survie n'est guère plus brillant : 16 % à 3 ans et 12 % à 5 ans.
-
Le type histologique et la topographie de la tumeur influent sur le pronostic. En effet, les tumeurs intimales comme les angiosarcomes ou les sarcomes intimaux ont par opposition aux tumeurs murales comme les léiomyosarcomes un plus grand potentiel de dissémination métastatique. Pour les tumeurs murales, le taux de survie est de 40 % à 3 ans et de 30 % à 5 ans. Pour les tumeurs intimales, il est de 5 % à 3 ans et de 3 % à 5 ans du fait de la prévalence élevée des métastases et d'un nombre plus élevé de localisations secondaires par patient. 1 1
B) En fonction de la topographie
-
Les localisations les plus proximales comme l'aorte ascendante, la crosse aortique et l'isthme ont un pronostic encore moins bon, non seulement à cause d'un plus grand pouvoir disséminateur mais aussi parce que la chirurgie d'exérèse est grevée d'un taux de mortalité plus élevé. Ce dernier est de 38 % contre 13 % pour l'aorte thoracique descendante et abdominale. Cette mortalité postopératoire concerne 17 % des patients et résulte souvent d'embolies viscérales. En l'absence de traitement, soit 19,5 % des patients en méta-analyse, le taux de survie est de 13 % à 1 an et de 0 % à 3 ans.
C) En fonction du type histologique
-
Pour les léiomyosarcomes, sa rareté rend difficile de chiffrer un pronostic de toute façon assez sombre. Il est encore plus difficile de faire des recommandations sauf à les calquer sur celles concernant les léiomyosarcomes veineux, un peu plus fréquents. Seule une exérèse d'une exhaustivité semblable à celle décrite pour les sarcomes intimaux peut offrir au malade une chance de survie. La fréquente propagation transpariétale peut exiger le sacrifice de structures et d'organes voisins. La place du traitement complémentaire par radiothérapie ou chimiothérapie est discutée, adjuvante en général, son aptitude à prévenir les récidives et les métastases et à améliorer la survie n'ayant pas été démontrée.1 1 1 1 Une radiothérapie pré-opératoire pourrait favoriser l'extirpabilité de la tumeur. Cette radiothérapie est également proposée quand les marges de l'excision sont envahies. La chimiothérapie néo-adjuvante ou adjuvante avec des protocoles de type doxorubicine/ ifosfamide ou gemcitabine/Taxotère® n'a pas fait la démonstration de son efficacité en termes de survie globale ou de diminution du risque de récidive locale ou de métastases.1 Elle relève de la concertation pluridisciplinaire pour le traitement de récidives avec métastases.1 Quant au pronostic, on déduit de l'extrapolation des localisations veineuses 1 1 1 1 1 1 1 une extirpabilité macroscopique dans plus de 80 % des cas, un taux de récidive locale ou de métastases d'environ 50 % et un taux de survie à 5 ans de 40 %. Le pronostic dépend de l'absence d'exérèse exhaustive1, d'un volume tumoral de plus de 9 cm, du grade histologique élevé et de la localisation proximale.
-
Pour les angiosarcomes, la chimiothérapie adjuvante, en général par la doxorubicine, semble réduire le risque de récidive locale (81 % contre 75 %) et de rechute (70 % contre 60 %) après chirurgie.1 Toutefois, la durée moyenne de survie reste médiocre, de l'ordre de 15 mois, et le taux de survie à 5 ans de 10 à 35 %.1 Les thérapeutiques ciblées anti-angiogéniques pourraient s'avérer efficaces et devraient être tentées.
-
Pour les tumeurs à malignité potentielle, une chimiothérapie complémentaire n'est proposée que quand la malignité est affirmée. L'efficacité de cette chimiothérapie n'a toutefois pas été évaluée vu le faible nombre de cas. Il en va de même pour la radiothérapie complémentaire après l'exérèse insuffisante ou impossible d'une tumeur qui a affirmé sa malignité.
D) Chimiothérapie
- L'effet de la chimiothérapie adjuvante après résection (doxorubicine, ifosfamide, gemcitabine) sur le pronostic des sarcomes en général, et des sarcomes aortiques en particulier, reste un sujet de débat, et il semble qu'elle n'améliore ni la durée ni les taux de survie.1 1 Il en est de même pour la radiothérapie qui ne semble recommandée que dans les cas où la chirurgie est impossible et sur des localisations secondaires osseuses. Il n'y a toutefois pas eu d'évaluation de ces deux thérapeutiques adjuvantes à la chirurgie en raison de la rareté de ce type de tumeur, et leur prescription doit faire l'objet d'une concertation oncochirurgicale multidisciplinaire.
PRÉVENTION
Votre texte ici
SURVEILLANCE
Votre texte ici
CAS PARTICULIERS
Votre texte ici
THÉRAPIES FUTURES
Votre texte ici
