Colite à Clostridium Difficile

INTRODUCTION/GÉNÉRALITÉ
-
Clostridium difficile, reclassée depuis 2013 comme Peptoclostridium difficile, est une bactérie gram positive, anaérobie stricte, responsable de colites dont le modèle est la colite pseudo-membraneuse survenant à l’occasion d’une antibiothérapie.
-
La colite à C. difficile (CCD) reste la principale cause de diarrhée nosocomiale, mais on observe une augmentation de cas communautaires.
-
La prise en charge thérapeutique repose sur la sévérité de la colite, le nombre d’épisodes d’infection à C. difficile et les facteurs de risques de récidives.1
HISTORIQUE
Votre texte ici
PHYSIOPATHOLOGIE
A) Mécanismes conduisant à la colite à Clostridium difficile
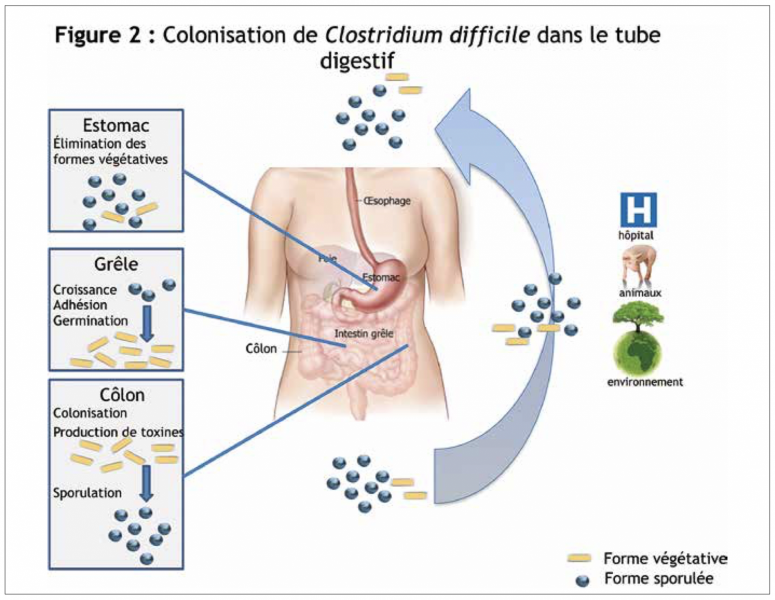
1) Colonisation de Clostridium difficile dans le tube digestif
-
Cette bactérie se transmet par voie oro-fécale, soit directement par manuportage soit à partir de l’environnement contaminé par l’homme ou certains hôtes animaux (porcs).
-
Les spores de Clostridium difficile sont très résistantes et sont les véhicules des formes végétatives qui, elles, ne résistent ni à l’oxygène de l’environnement ni à l’acidité gastrique.
-
Dans le tube digestif, la capacité des spores à croître et à coloniser l’intestin est fortement influencée par le microbiote et son activité métabolique. Par exemple, les changements induits par une prise d’antibiotique dans la structure du microbiote peuvent générer un environnement propice à cette colonisation.
-
L’adhésion des spores est suivie d’une germination et d’une colonisation des espèces végétatives. La germination des spores en formes végétatives est dépendante de facteurs d’hôtes, tels que les acides biliaires primaires (acide taurocholate). La colonisation est dépendante elle aussi de facteur d’hôtes, tels que certains récepteurs de l’immunité innée : les Toll-like Receptors (TLR) TLR-4 et 5, MyD88 et NOD1 dont l’expression est induite par le peptidoglycane, la flagelline et d’autres molécules de surface de Clostridium difficile.
-
Ces formes végétatives ayant ainsi colonisé le tube digestif vont ensuite exprimer leurs facteurs de virulence dont la production de toxines.
-
La sporulation des formes végétatives aura lieu dans le côlon avant l’élimination dans l’environnement pour un nouveau cycle de colonisation
2) Pathogénicité
-
Seules les souches de Clostridium difficile toxinogènes sont pathogènes.
-
Il existe sur le génome des souches pathogènes un locus codant pour des toxines : TcdcA pour la toxine A, TcdB pour la toxine B, et 3 gènes de régulations dont TcdC, gène répresseur de l’expression des toxines A et B 1. Il existe un autre locus codant pour les gènes d’une toxine binaire.
-
Les souches épidémiques hyper-virulentes de ribotype 027 (nouveau variant) possèdent une mutation dans le gène TcdC entrainant une production non régulée de toxines A et B7.
-
La production des toxines est dépendante des souches mais également de nombreux facteurs d’environnement liés à l’hôte qui influencent l’expression de ces toxines.
-
Une fois sécrétées, les toxines A et B se lient, puis pénètrent dans les cellules de l’épithélium colique et entraînent une cascade d’évènement conduisant à la synthèse de cytokines et de chimiokines pro-inflammatoires, au recrutement de neutrophiles, à la rupture des jonctions serrées, la sécrétion hydro-électrolytique et in fine à la mort cellulaire par apoptose et par nécrose. La nécrose est habituellement associée aux CCD sévères.
-
La toxine B est donc capable à elle seule de rendre compte de la pathogenèse des CCD.1
ÉPIDÉMIOLOGIE
A) Une infection nosocomiale
-
Clostridium difficile représente le principal entéropathogène responsable de diarrhée infectieuse nosocomiale chez l’adulte.1
-
En Europe, on estime que l’incidence des CCD nosocomiales est d’environ 120 000 cas par an.1
-
En France, l’incidence des CCD dans les établissements de santé est estimée à 2,3 cas pour 10000 patients-jours.1
-
La transmission par des spores de Clostridium difficile présents dans l’environnement et chez certains animaux fait que les humains sont de plus en plus colonisés.
-
Il convient de rappeler que les patients admis à l’hôpital sont généralement beaucoup plus colonisés que les sujets non admis, du fait de l’exposition à un environnement hospitalier, une antibiothérapie, et des comorbidités.
B) Une infection communautaire
-
On observe depuis quelques années une augmentation des cas communautaires.1
-
On estime que l’incidence des CCD communautaires est de l’ordre de 30 à 120 pour 100 000 personnes-années aux États-Unis d’Amérique et de 390 à 780 pour 100000 personnes-années aux Pays-Bas.1 Ces chiffres sont équivalents à ceux des infections à Campylobacter spp. et au-dessus de ceux des infections à Salmonella spp.1
-
Il est important de noter que dans plus de 30 % des cas de CCD communautaires, on ne retrouve pas les facteurs de risque classiques que sont une prise d’antibiotique et/ ou une hospitalisation récente.
C) Mortalité
-
La mortalité au cours d’une diarrhée simple attribué à Clostridium difficile est inférieure à 1 %.
-
Néanmoins, en dehors des ribotypes responsables d’épidémie, la mortalité des CCD est de l’ordre de 15 à 20 % avec dans la moitié des cas une mortalité directement attribuable.
-
Des comorbidités chez les patients atteints de CCD sont fréquemment observées et contribuent largement à la mortalité.
-
En cas d’infection sévère (méga-côlon toxique), la mortalité peut atteindre jusqu’à 50 % des cas.
-
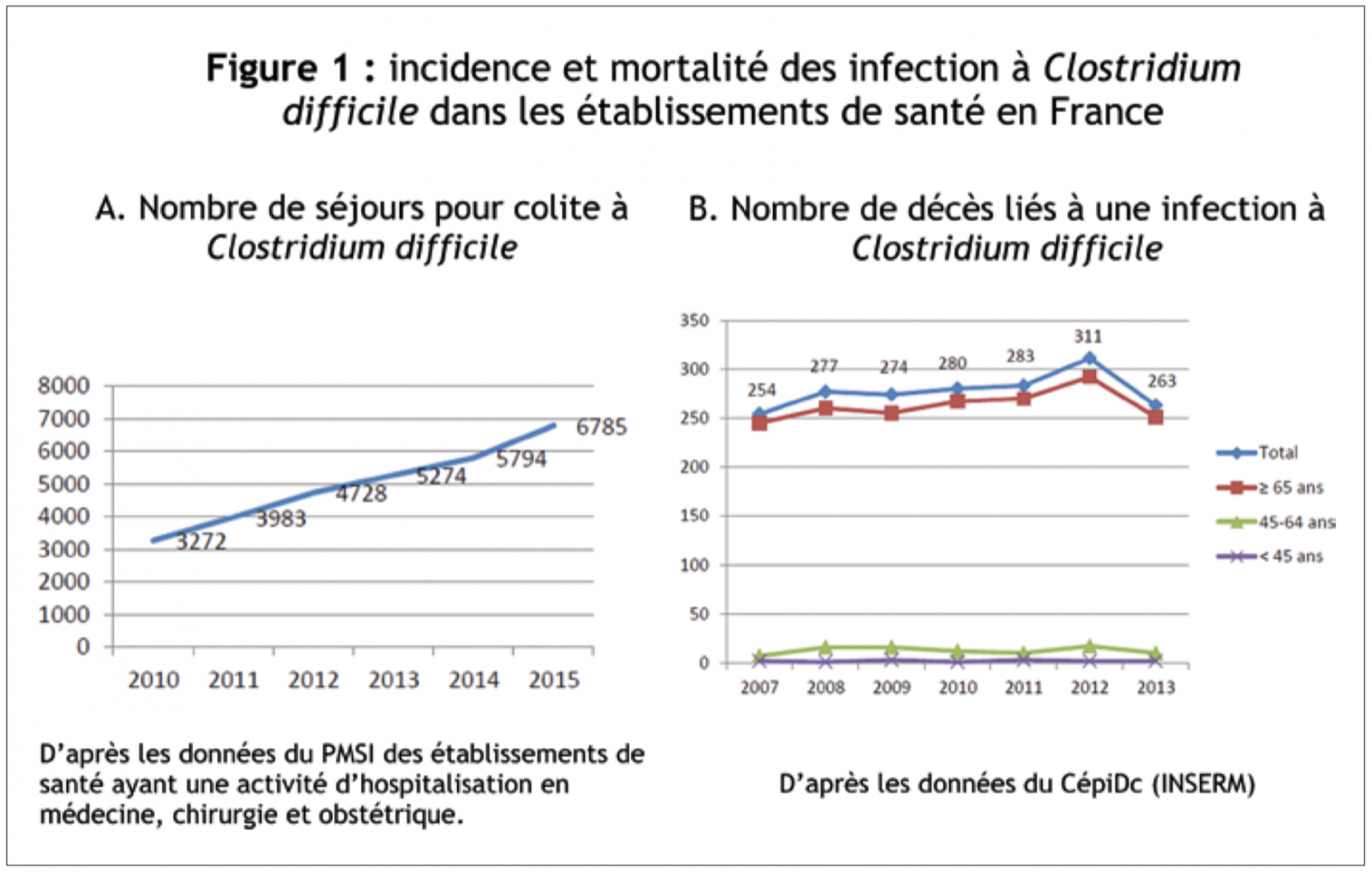
D’après les données du CépiDc (INSERM), le nombre de décès liés à une CCD en France métropolitaine varie entre 254 et 311 par an pour la période 2007-2013 (Figure 1B).1
FACTEURS DE RISQUES
A) Les principaux facteurs de risque de CCD :
-
l’administration d’antibiotiques, certains étant plus pourvoyeurs que d’autres,
-
l’âge supérieur à 65 ans,
-
les antécédents d’hospitalisations,
-
la présence d’une maladie inflammatoire chronique intestinale
-
les procédures modifiant l’écosystème intestinal (laxatifs, inhibiteurs de la sécrétions acides, ralentisseurs du transit, etc.).1

EXAMEN CLINIQUE
A) Le portage asymptomatique
-
Environ 3 % des adultes sont porteurs sains de Clostridium difficile .
-
Exceptionnellement (< 1 %), les toxines de Clostridium difficile peuvent être mises en évidence dans les selles de patients adultes asymptomatiques.
-
En revanche, le portage asymptomatique de souches toxinogènes est beaucoup plus fréquent chez les nourrissons et chez les patients hospitalisés.
B) manifestations digestives
Il existe 2 groupes distincts : la diarrhée post-antibiotiques (de sévérité relative) et la colite pseudo-membraneuse.
1) La diarrhée post-antibiotique « simple » sans colite avérée
-
Le tableau clinique consiste en une diarrhée fécale (au moins 3 selles non formées par jour, sans glaires ni sang visibles).
-
Une fièvre modérée est possible, mais il n’y a pas d’altération marquée de l’état général.
-
Si une endoscopie colique était pratiquée (elle n’est pas nécessaire dans ce contexte clinique), elle mettrait en évidence une muqueuse d’aspect normal ou au plus un érythème, sans pseudomembrane ni ulcération.
2) La colite pseudomembraneuse
-
La présentation clinique de la colite pseudomembraneuse est plus bruyant 1 : elle débute par une diarrhée liquide abondante (> 7 selles/jour), faite de elles hétérogènes en général non sanglantes.
-
Elle est souvent accompagnée de fièvre (> 65 %) et de douleurs abdominales (70 %).
-
Un syndrome biologique inflammatoire (hyperleucocytose et élévation nette du taux sérique de la protéine C réactive) est habituel.
-
L'ASP peut montrer une aérocolie diffuse.
-
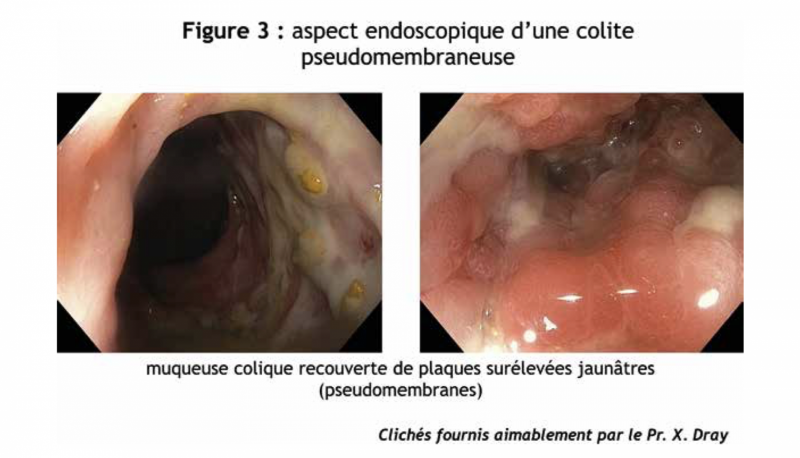
À l’endoscopie, la muqueuse colique est recouverte de plaques surélevées jaunâtres (pseudomembranes) éparses ou confluentes selon le stade de la maladie (Figure 3). Elles sont constituées de débris cellulaires, de mucus, de fibrine et de leucocytes. Dans plus de deux tiers des cas, les lésions intéressent notamment le rectum et peuvent donc être visualisées aussi bien par une simple rectoscopie au tube rigide que par une coloscopie courte.
EXAMENS COMPLÉMENTAIRES
A) Diagnostic positif d’infection à Clostridium Difficile
-
Pour poser le diagnostic de CCD, la société européenne de microbiologie, retient l’association d’un tableau clinique compatible et la preuve microbiologique de la présence d’une souche de Clostridium difficile productrice de toxines dans les selles, sans autre cause de colite.
B) Les tests disponibles
Pour faire la preuve d’une souche de Clostridium difficile productrice de toxines dans les selles plusieurs tests sont disponibles.1
1) Test de cytotoxicité
-
Ce test est considéré comme la méthode de référence de détection des toxines et de leur toxicité sur des cellules en culture. Cette méthode est assez longue (24 à 48 h) et « lourde ». Elle est très spécifique mais peu sensible. En cas de positivité, elle signe la présence de la maladie.
2) La culture toxigénique
-
Elle consiste en une culture sur milieux sélectifs pour isoler les colonies de Clostridium difficile puis la détection in vitro des toxines par quelque tech-ique que ce soit.
3) La détection de la glutamate déshydrogénase (GDH) dans les selles
-
Il s’agit d’un test immuno-enzymatique permettant de mettre en évidence dans les selles cette enzyme caractéristique de Clostridium difficile. Cette enzyme est produite aussi bien par les souches toxinogènes que par les souches non toxinogènes. En cas de positivité, ce test doit donc ensuite être couplé à la recherche de toxines pour s’assurer qu’il s’agit bien d’une souche pathogène.
4) La mise en évidence des toxines libres dans les selles
-
Elle se fait également à l’aide de tests immuno-enzymatiques (résultat pouvant être obtenu en 30 minutes) qui permettent de détecter la toxine A ou les toxines A et B simultanément.
5) Les TAANs : techniques d’amplification des acides nucléiques de Clostridium difficile
-
Le test le plus couramment utilisé est la PCR en temps réel qui permet la détection qualitative d’ADN de Clostridium difficile. Elle cible le plus souvent les gènes qui codent les toxines A et B ou le gène tcdC (répresseur de la production des toxines).
-
La positivité d’un TAAN signifie la présence de Clostridium difficile potentiellement toxinogène (c’est-à-dire ayant la capacité de produire des toxines) mais ne donne pas d’information vis-à-vis de la production effective, in vivo, de toxines.
-
Les TAANs peuvent donc être à l’origine d’un sur-diagnostic.
C) Stratégie diagnostique
-
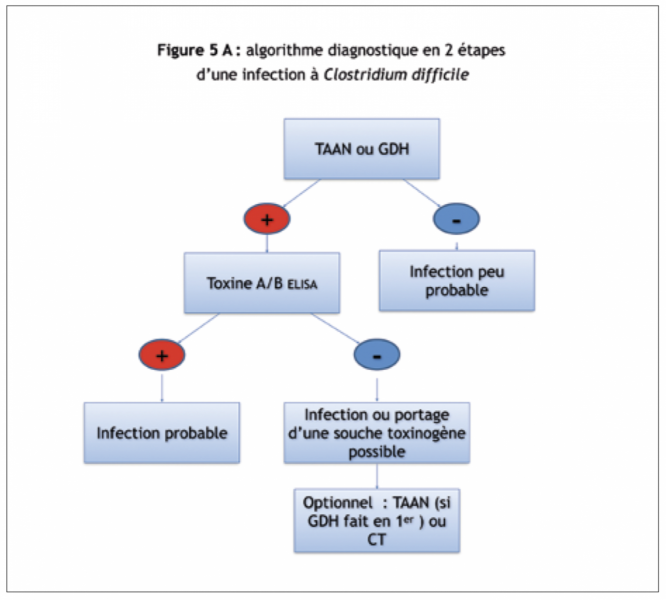
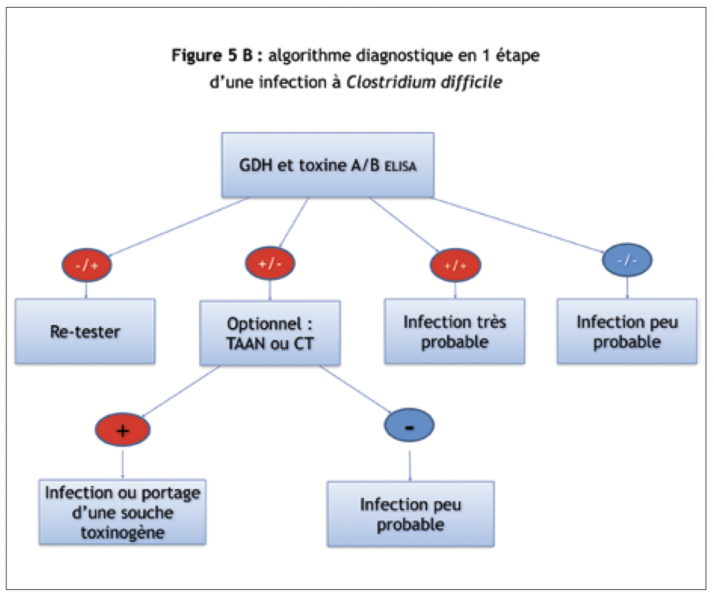
Le diagnostic microbiologique de CDD repose sur la recherche de la preuve conjointe du germe (GDH ou culture) et des toxines ou de ses gènes, en une ou deux étapes.1
-
Deux algorithmes peuvent être proposés (Figures 5A et 5B).
-
En attendant un meilleur niveau de preuve sur la valeur des TAANs, il semble raisonnable de privilégier une stratégie en 2 temps (Figure 5A) avec, dans un premier temps la recherche de la GDH, et, en cas de positivité, la réalisation d’un ELISA des toxines.
-
En cas de GDH négatif mais de forte suspicion d’infection à Clostridium difficile, on propose de débuter un traitement en attendant les résultats des tests des toxines, voire des tests de référence.
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
A) Formes graves
-
Les principales complications de la colite pseudomembraneuse sont la colite fulminante et le mégacôlon toxique qui doivent faire l’objet d’une prise en charge médico-chirurgicale.
-
Un âge supérieur à 70 ans, des rechutes et la présence d’au moins 2 co-morbidités sont des facteurs associés de manière significative à une forme grave d’infection.
-
Les manifestations systémiques comprennent une altération profonde de l’état général avec diarrhée profuse et déshydratation pouvant évoluer secondairement vers le choc hypovolémique. L’abdomen est douloureux et tendu.
-
Une polynucléose supérieure à 20 000/mm3 est fréquente, en association en général avec une hypoalbuminémie marquée.
-
Lorsque le diamètre du colon transverse dépasse 6 cm sur le cliché de l’abdomen sans préparation ou à l’examen tomodensitométrique, on parle de mégacôlon toxique. Dans ce cas, la diarrhée peut être absente. Au cours des formes sévères de CCD, le scanner abdominal contribue de façon importante à la prise en charge. Il constitue tout d’abord une aide diagnostique en montrant un épaississement des haustrations en«accordéon» dans 7 à 15% des cas (Figure 4). Il permet également de diagnostiquer la présence d’une ascite, qui est un bon marqueur de sévérité de la colite.. Enfin, le scanner abdomino-pelvien, qui visualise constamment les pneumopéritoines, même minimes, permet de déceler les perforations coliques en péritoine libre, qui constituent une indication chirurgicale formelle de colectomie subtotale en urgence.1

B) Les récidives
-
Les CCD sont caractérisées par un risque élevé de rechute pouvant atteindre 20 % après le premier épisode, 40 % après un deuxième épisode et 60 % après trois épisodes.1
-
La récidive est définie par la réapparition des symptômes dans les 8 semaines suivant un épisode documenté et résolutif après un traitement bien conduit.
-
Dans 77 % des cas, les rechutes sont liées à la persistance de la souche initiale sous formes sporulées (récidive vraie) et pour les 23 % de cas restants, à l’acquisition d’une nouvelle souche (réinfection), le plus souvent au cours d’une hospitalisation.1
PRISE EN CHARGE THÉRAPEUTIQUE
A) Mesures générales
-
Le traitement est guidé par le nombre d’épisode, la clinique (sévérité) et les co-morbidités. 1
-
Il n’y a pas d’indication à traiter les porteurs asymptomatiques.
-
De façon générale, le traitement des CCD comprend l’arrêt de tout agent ralentisseur du transit, la rééquilibration hydro-électrolytique quand elle est nécessaire et, si possible, l’interruption du ou des antibiotique(s) inducteur(s) ou leur modification pour un antibiotique à faible risque.
-
En cas de CCD une anti-biothérapie spécifique est nécessaire.
B) Traitement d’un premier épisode de CCD
1) Vancomycine PO
-
La vancomycine par voie orale est dorénavant le traitement de première ligne recommandé par la plupart des sociétés savantes notamment la société américaine de maladies infectieuses.1
-
La dose dépend de l’évaluation clinique : en cas de forme non sévère 125 mg x 4 par jour pendant 10 jours sera recommandé alors qu’en cas de colite fulminante 2 g par jour seront généralement nécessaires.
-
Administrée per os, la vancomycine n’est pratiquement pas absorbée par la muqueuse digestive et n’induit pas les effets secondaires oto-toxiques et néphrotoxiques observés lors d’un traitement intra-veineux.
-
La vancomycine peut être donnée par voie intra-colique (lavement, sonde naso-gastrique, iléostomie).
2) Fidaxomicine
-
La fidaxomicine est un antibiotique de type macrolide très peu absorbé ayant reçu une AMM en 2012 pour le traitement des CCD.
-
En effet, la fidaxomicine (200 mg x 2/j pendant 10 j) a montré une efficacité comparable à la vancomycine (125 mg x 4/j pendant 10 j) à travers deux essais randomisés contrôlés. Un autre essai a montré une meilleure prévention des rechutes par la fidaxomicine que par la vancomycine (15,3 % versus 25,3 % respectivement).1
-
La fidaxomicine peut donc être utilisée en traitement de première ligne en cas de premier épisode de CCD. Néanmoins, son coût élevé rend son utilisation plus limitée dans cette indication.
3) Métronidazole PO
-
Le métronidazole oral 500 mg x 4 par jour pendant 10 jours, largement utilisé en première ligne auparavant, est dorénavant relégué en cas de contre-indication à la vancomycine ou à la fidaxomicine.
-
Il peut être également utilisé par voie intra-veineuse (500 mg/6 heures) lorsqu’une administration per os est difficile ou impossible (vomissements ou chirurgie abdominale récente, iléus).1
-
Il est ainsi recommandé en association avec la vancomycine en cas de colite fulminante.
-
Le métronidazole peut être responsable d’effets secondaires (nausées, vomissements, goût métallique, éruption ou rash cutané, effet antabuse lors de prise d’alcool, neuropathie périphérique en cas de traitement prolongé).
C) Traitement de la première récidive
-
On dispose de peu de données dans cette indication. 1
-
Il est généralement recommandé d’utiliser un traitement n’ayant pas été employé lors du premier épisode.
-
Étant donné sa bonne tolérance et sa supériorité pour prévenir les rechutes, la fidaxomicine est donc potentiellement indiquée dans ce cas.1
-
Un protocole de vancomycine à dose décroissante (pleine dose pendant 2 semaines, puis diminution de 250 mg par semaine) peut être utilisé également.1
D) Traitement chirurgical
-
En cas de perforation, de mégacôlon toxique, de péritonite avec défaillance organique ou d’échec du traitement médical, le traitement chirurgical de sauvetage consiste en une colec- tomie subtotale avec double stomie (iléostomie et sigmoïdostomie), indis- pensable pour éviter l’issue spontanée habituellement fatale d’une colite grave à Clostridium difficile.1
-
Néanmoins, la mortalité péri-opératoire de cette chirurgie de sauvetage sur un terrain très débilité reste élevée, allant jusqu’à 50 %.1
-
Certains auteurs ont rapporté l’intérêt d’une chirurgie conservatrice de type Malone ou iléostomie afin d’instiller la vancomycine en intra-colique.1 La place de cette procédure reste à définir.
E) Traitement alternatifs
-
D’autres traitements semblent efficaces pour traiter une CCD.
-
Certains antibiotiques à spectre plus étroit sont en développement (le ridinilazole et la surotomycine).1
-
L’administration de spores de Clostridium difficile non toxinogène ou d’une centaine de firmicutes (SER-109) sont 2 stratégies faisant l’objet d’essais randomisés.1
-
L’immunisation passive par l’administration d’anticorps monoclonaux anti-toxine B a montré son efficacité à travers 2 essais randomisés de phase 3 publiés dans le New England Journal of Medecine.1 Ce traitement a reçu une autorisation d’utilisation par la FDA en cas de CCD récidivantes. Les anticorps monoclonaux anti-toxine A semblent moins efficaces et pourraient être utilisés en synergie avec le Bezlotoxumab.
-
Enfin, la transplantation de microbiote fécal (TMF) de sauvetage ou la perfusion d’immunoglobulines n’ont à ce jour qu’une place anecdotique dans le traitement d’une CCD.
ÉVOLUTION/PRONOSTIC
Votre texte ici
PRÉVENTION
A) Prévention
-
L’acquisition nosocomiale de Clostridium difficile reste très fréquente ; ainsi, la prévention de l’acquisition de Clostridium difficile est un temps essentiel de la prise en charge de cette d’infection. 1
-
Le tableau 2 rappelle les actions de prévention préconisées par les experts (Haut conseil de la santé publique, 2008).

B) Prévention des récidives
-
Concernant le cas particulier des récidives, le Groupe Français de Transplantation de microbiote Fécal (GFTF) relayé par un consensus européen a récemment émis des recommandations.1
-
En effet, la transplantation de microbiote fécale (TMF) est indiquée en prévention des CCD récidivantes à partir de la seconde récidive (soit le 3e épisode) et après échec au minimum d’un traitement bien conduit par vancomycine ou fidaxomicine. Cette procédure donne des taux de succès supérieurs à 85 %.1 En l’état actuel des connaissances, il n’existe pas de situation contre-indiquant la TMF.1
-
La séquence thérapeutique comporte trois étapes : (I) une antibiothérapie par vancomycine, (II) une préparation colique et (III) l’administration du microbiote qui peut se faire par lavement, au cours d’une coloscopie ou par une sonde naso-duodénale. Les critères de sélection du donneur et les procédures ont été proposés par le GFTF et sont accessibles sur le site Groupe Français de Transplantation Fécale.
SURVEILLANCE
A) Critère de guérison
-
L’efficacité d’un traitement repose sur des critères cliniques (amélioration de la symptomatologie digestive) et biologiques(diminution très précoce en cas d’efficacité thérapeutique du taux sérique de protéine C réactive).
-
Dans le cadre d’une colite sévère, compte tenu des enjeux évolutifs, les lignes thérapeutiques doivent s’envisager par périodes de 48 h. En cas de non-réponse à la vancomycine associée au métronidazole IV, l’administration de vancomycine par iléostomie peut être discutée avec l’équipe chirurgicale avant la réalisation d’une colectomie sub-totale.
-
Dans tous les cas, la réalisation d’une coproculture de contrôle à l’issue du traitement n’est pas recommandée1 et c’est le retour au transit initial qui signe la guérison et la levée de l’isolement.
CAS PARTICULIERS
Votre texte ici
THÉRAPIES FUTURES
Votre texte ici
