Cystite interstitielle

INTRODUCTION/GÉNÉRALITÉ
La cystite interstitielle (CI) est une pathologie inflammatoire chronique de la paroi de la vessie.
La Société internationale de continence a remplacé la terminologie “cystite interstitielle” par celle de “cystite interstitielle-syndrome de vessie douloureuse” (IC-painful bladder syndrome). Cette nouvelle terminologie est définie ainsi selon l’ESSIC 2005 (European society for the study of IC/PBS) : 1
- le syndrome de vessie douloureuse se définit par une douleur sus-pubienne en relation avec le remplissage vésical et accompagnée de symptômes tels qu’une pollakiurie et une nycturie, en l’absence d’autres pathologies telles qu’une infection urinaire.
- la cystite interstitielle fait partie des syndromes de la vessie douloureuse avec en plus des caractéristiques typiques cystoscopiques et/ou histologiques en l’absence d’infection urinaire ou d’autres pathologies.
HISTORIQUE
- Avant que le monde médical ne reconnaisse la cystite interstitielle comme une véritable maladie, elle était considérée comme une manifestation hystérique. Une des explications 1 veut que la cystite interstitielle soit une maladie psychosomatique masochiste. Pour Campbell,1 la CI serait une maladie qui représenterait le stade terminal d'une vessie rendue irritable par des troubles émotionnels, un moyen de chasser des haines inconscientes.
- Une étude américaine 1 récente a montré que les premières descriptions de la CI étaient, en fait, réalisées par Philip Syng Physick qui avait décrit, en 1808, un état inflammatoire de la vessie produisant les mêmes symptômes du bas appareil urinaire que la lithiase vésicale.
- En 1836, ce concept fut plus élargi, en incluant une pollakiurie chronique, une impériosité mictionnelle et un syndrome douloureux qui apparaissent en l’absence d’autres étiologies.
- Pour d’autres auteurs,1 la CI serait initialement décrite par Skene, en 1878, chez des femmes présentant une inflammation intramurale, interstitielle de la paroi vésicale; et en 1907, Nitze lui attribua le terme de “cystitis parenchymatosa”.
- C’est Guy Hunner,1 un gynécologue américain, qui a décrit en 1915 la forme ulcéreuse de la Cystite Interstitielle chez des femmes présentant des douleurs vésicales associées à des urgences mictionnelles. Elle fut alors individualisée sous le nom d’ulcération de Hunner.
- En 1978, Mesing et Stamey avaient affirmé qu’il existait des formes non ulcéreuses de la CI et que les glomérulations vésicales sont indispensables au diagnostic.1
- C’est dans les années 80, qu’a été créée, aux USA, une association de malades, Interstitial Cystitis Association (ICA), visant à populariser et à vulgariser auprès du grand public et dans le milieu médical la cystite interstitielle.
- En 1987-1988, la conférence de consensus des Instituts Nationaux de Santé américains a établi les critères diagnostiques de la CI permettant une homogénéisation des populations étudiées.1
- C’est seulement au cours de ces trois dernières décennies que les connaissances cliniques, physiopathologiques et thérapeutiques de cette maladie ont progressé donnant à la cystite interstitielle un cadre pathogénique plus précis.
Histologie
Sur le plan histologique, on distingue la forme majeure et la forme mineure (non ulcéreuse).1
A) Forme majeure
- Elle est de type inflammatoire.
- Elle concerne la femme âgée et est plus fréquente en Europe, spécialement dans les pays nordiques.
- Elle associe une pollakiurie douloureuse, une vessie de capacité réduite à des lésions endoscopiques caractéristiques et des images antomo-pathologiques typiques.
- Sur le plan histologique, il s’agit d’une pancystite dans tous les cas.
- L’ulcère de Hunner correspond à une abrasion totale de l’épithélium et de sa membrane basale, qui est remplacée par un enduit fibrino-leucocytaire reposant directement sur un chorion très inflammatoire. Le fond de l’urothélium est constitué par du tissu de granulation dont les cellules peuvent s’organiser en follicules lymphoïdes à centre clair.
- En dehors de cette lésion typique, l’épithélium est très aminci, réduit, le plus souvent à deux couches de cellules. Le chorion sous-jacent, est constamment remanié par un fibro-œdème qui l’épaissit de manière significative; il contient une abondante population inflammatoire comprenant inconstamment des îlots lymphoïdes et surtout un infiltrat en bande sous épithéliale comprenant des lymphocytes, histiocytes et éventuellement des polynucléaires éosinophiles et surtout de nombreux plasmocytes. Des lésions de cystite kystique peuvent être associées. La musculeuse est épaissie en raison de l’existence d’une hyperplasie désorganisée des faisceaux musculaires lisses qui sont séparés par des bandes de fibrose lâche, ne s’accompagnant que rarement d’une infiltration lymphoïde. Il n’y a jamais de plasmocytes à ce niveau. Les capillaires sont dilatés, hémorragiques. Il existe parfois des infiltrats inflammatoires péri nerveux. De plus, il existe une diminution des polysaccharides acides. Cette constatation se voit souvent dans les formes évoluées. Les lésions prédominent sur la couche interne avec, assez souvent, dans ces formes majeures, une atteinte de la couche externe.
- Toutes ces modifications histologiques ne se voient que dans les formes déjà évoluées de la maladie, sur des biopsies profondes intéressant largement le détrusor ou sur des pièces opératoires correspondant au maximum à une cystectomie totale.
B) Forme mineure
- Elle, est de type neurogène et domine aux Etats-Unis.
- Elle concerne la femme jeune, à capacité vésicale normale et ses lésions endoscopiques n’apparaissent qu’après distension vésicale.
- Cette forme reste d’une approche plus difficile d’autant que les lésions anatomo-pathologiques sont loin d’être caractéristiques. Les lésions sont moindres, mais la paroi vésicale n’est jamais normale.
- Il n’y a pas d’ulcération mais une congestion vasculaire importante et des zones de fragilisation de l’urothélium avec vacuolisation apicale et décollement parcellaire. Le plus souvent l’épithélium est aminci, réduit à une ou deux couches, mais il peut aussi être normal de façon locale. Ces îlots d’épithélium normal étant séparés par des zones où l'épithélium est aminci, rendent difficile le diagnostic différentiel. Le cytosquelette peut être altéré, chose montrée par immuno-histochimie avec marquage des filaments de kératine. Parfois, la basale est mise à nue, mais elle est toujours préservée. Le chorion est siège d’une sclérose variable et d’un oedème qui pourrait être lié à l’acte biopsique. L’infiltrat inflammatoire dans le chorion est identique à celui des formes majeures, mais moins marqué. Il contient un nombre abondant de mastocytes (élément considéré comme spécifique de la maladie) ainsi que des polynucléaires éosinophiles et des plasmocytes. La musculeuse présente, au maximum, une fibrose moins dense que dans les formes majeures, inter-fasciculaire sans spécificité et quelques mastocytes épars. Il n’y a pas d’infiltrat péri-nerveux, mais peuvent exister des fissures linéaires.
- Cet aspect morphologique peut se rencontrer dans d’autres pathologies telles que la cystite chronique non spécifique ou au voisinage d’un carcinome urothélial in-situ. Les résultats de la cystoscopie sont parfois discutables dans les formes mineures où la paroi peut apparaître peu modifiée, voire normale contrairement aux formes majeures où ils sont plus spécifiques.
- Ces formes mineures posent un problème de diagnostic histologique, car les lésions observées sont peu spécifiques, subjectives et variables d’une biopsie à l’autre chez un même patient. De plus, dans ces formes mineures, la maladie peut réaliser un caractère focal et il ne faut pas hésiter à prendre les fragments biopsiques dans les sites différentiels. Le problème est compliqué par le fait que l’histologie de la vessie normale se modifie avec l’âge avec constitution d’une fibrose à des degrés variables. Toutefois, les lésions observées dans les vessies normales sont toujours moindres que dans le cas des formes mineures des cystites interstitielles.
- L’apport de la biopsie n’est pas indispensable au diagnostic, car il n’existe à ce jour que des éléments en faveur de la cystite interstitielle sans aucun aspect pathognomonique évoquant cette pathologie. Néanmoins, le rôle essentiel de l’histologie est d’éliminer les autres pathologies surtout le cancer in situ mais aussi la tuberculose, le lupus, ou la cystite à éosinophile.
PHYSIOPATHOLOGIE
L’étiologie de la cystite interstitielle reste indéterminée. Les différentes études suggèrent que sa physiopathologie est multifactorielle :
A) Hypothèses de l’altération de la perméabilité de la paroi vésicale
- L’intérieur de la vessie est normalement tapissé par une couche de protéines (glycosaminoglycanes notamment) dont le rôle est de protéger la paroi des composants agressifs et toxiques de l’urine. Or cette couche protectrice est déficiente (et donc perméable) chez 70% des personnes atteintes de cystite interstitielle. Les éléments toxiques (par exemple le potassium concentré) pourraient alors pénétrer la paroi de la vessie, provoquer une inflammation et déclencher la cystite.
- Par ailleurs, les chercheurs ont isolé une substance appelée « facteur antiprolifératif » (APF) présente presque uniquement dans l’urine des patients atteints de CI. L’APF pourrait, chez ces patients, empêcher la croissance de nouvelles cellules vésicales saines et donc le renouvellement de la paroi de la vessie.
B) Hypothèse de la cellule mastocytaire
- Les mastocytes sont des cellules ubiquitaires du tissu conjonctif et des sous muqueuses. Ils ont un rôle dans l’hypersensibilité et l’inflammation. Leur action sur les fibres musculaires lisses, l’épithélium vasculaire et dans l’inflammation est due à la libération des produits de leurs granules de sécrétion tels que l’histamine, la prostaglandine, le leucotriène et certaines enzymes. Selon certains auteurs,1 ce sont ces granulations, notamment l’histamine qui pourraient expliquer les manifestations cliniques et histologiques de la CI.
- Cependant, les stimulis de la dégranulation des mastocytes ne sont pas connus. Il pourrait s’agir de substances toxiques urinaires, de neurotransmetteurs du système nerveux autonome, d’allergènes, d’immunoglobulines (récepteurs aux IgE), de facteurs mécaniques ou de cytokines. Les arguments qui plaident en sa faveur sont la forte densité de mastocytes dans la paroi vésicale des patientes présentant une CI bien qu’il n’existe aucun critère histologique spécifique de cette pathologie, l’augmentation de l’histaminurie chez les patientes atteintes de CI notamment après hydrodistension et enfin, l’association à la CI aux allergies multiples dans près de 50% des cas. En outre, il a été proposé qu’une densité de mastocytes dans le détrusor dépassant 28 cellules par millimètre soit un argument important pour établir le diagnostic de CI.1 Une étude récente 1 a insisté sur l’aspect fonctionnel des mastocytes plus que sur leur nombre. Actuellement, les voies de recherche sur la pathogénie de la CI s’orientent vers le dosage urinaire des produits de dégranulation des mastocytes (PgE2, histamine et métabolites.).
- El-Mansoury a étudié la variation du taux d’histamine dans les urines des patientes souffrant de CI. Dans son étude menée sur 37 patients avec CI, il met en évidence une augmentation significative du méthyl-histamine dans les urines et souligne l'intérêt potentiel de ce dosage comme outil diagnostique de la CI.1
C) Hypothèse infectieuse
- Une infection virale ou bactérienne ancienne pourrait être à l’origine du dérèglement du système immunitaire.
D) Hypothèse neurologique
- Par modification de la répartition des terminaisons nerveuses dans la paroi vésicale : On a rapporté récemment une prolifération des terminaisons nerveuses dans la paroi de la vessie chez des patientes atteintes de CI.1
- Par dystrophie sympathique réflexe: cette théorie se base sur le fait que la douleur chronique est due fondamentalement à une activité sympathique anormale (dégranulation sympathique). Celle-ci aurait deux conséquences : une hypersensibilité des récepteurs sensitifs périphériques et une hypertonie vasomotrice sympathique ce qui réduit le flux sanguin, provoquant ainsi une douleur ischémique et des phénomènes trophiques comme la faiblesse de la paroi musculaire, la fragilité capillaire, la diminution des mécanismes de défense contre les infections…. Les travaux de Christmas et al. et d’Hohenfellner et al.1 soutiennent cette hypothèse.
E) Hypothèse auto-immune
- Elle repose sur le fait que la CI est souvent associée à des maladies auto-immunes telles que la polyarthrite rhumatoïde ou le lupus érythemateux systémique. De plus, plusieurs études 1 ont rapporté l’existence d’anticorps chez les patientes atteintes de CI.
F) Les autres hypothèses concernent des mécanismes génétiques ou environnementaux.
ÉPIDÉMIOLOGIE
- Le nombre exact de personnes atteintes par cette maladie est difficile à connaître car la maladie reste sous-diagnostiquée.
- La prévalence (nombre de cas dans une population donnée à un moment précis) varie selon les pays. En Europe, les estimations vont de 1/12 500 à 1/1500 cas. Aux Etats-Unis, la prévalence est estimée à 1/1500 environ.
- Tout le monde peut être touché, mais les patients souffrant de cystite interstitielle sont des femmes dans 90% des cas.
- L'âge moyen de survenue de la maladie se situe en moyenne entre 30 et 40 ans, et 25% des patients ont moins de 30 ans. Exceptionnellement, certains enfants peuvent présenter les symptômes de cette maladie, mais selon les critères officiels américains (« critères du NIH »), le diagnostic ne devrait être porté que sur les patients de plus de 18 ans.
- La cystite interstitielle peut toucher les personnes de toute origine, mais la prévalence de la maladie semble plus importante dans les pays occidentaux et les pays nordiques.
DIAGNOSTIC Positif
La CI reste très mal connue et il faut parfois attendre plusieurs années avant que le diagnostic soit établit.
Actuellement, il n’y a pas de signes ou de marqueurs spécifiques de la maladie. Le praticien doit procéder par élimination des maladies ressemblantes avant de pouvoir conclure à une CI : il s’agit d’un diagnostic d'élimination.

EXAMEN CLINIQUE
La maladie évolue par poussées entrecoupées de périodes de rémissions (diminution des symptômes). Les symptômes s’aggravent ou s’amenuisent avant et pendant les menstruations et en période de pré-ménopause, probablement en raison des changements hormonaux qui agissent sur les cellules de la vessie.
A) Les 3 symptômes principaux, peuvent varier en fréquence et en intensité et sont les suivants :
1) Pollakiurie diurne et nocturne :
- Il s'agit d'un besoin anormalement fréquent d'uriner sans que le volume d'urine produite ne soit augmenté et ce jour et nuit. Dans la plupart des cas il n’y a que quelques gouttes parce que la vessie est vide (même si les malades ont l’impression qu’elle est toujours pleine).
- Alors que les envies d’uriner normales sont espacées d’au moins deux heures et conduisent à effectuer 4 à 6 mictions par 24 heures, le besoin d’uriner en cas de CI est quasiment permanent.
- Le fait d’aller aux toilettes ne soulage presque pas le malade, et l’envie d’uriner peut revenir quelques minutes, voire quelques secondes après la miction.
- Cette envie parfois constante d’uriner amène les malades à uriner plus de 8 fois par 24 heures, 16 fois en moyenne et jusqu’à 50 fois dans les cas sévères.
- Elle peut être l'unique symptôme dans les formes peu sévères ou au début de la maladie.
- Cependant, chez la grande majorité des patients, il n’y a jamais de fuites d’urine involontaires.
2) Douleur abdominale sus-pubienne :
- Il s'agit de douleurs permanentes ou intermittentes s’intensifiant lorsque la vessie est pleine, et diminuant temporairement après la miction.
- Elle ressemble à celle d’une infection bactérienne mais est beaucoup plus violente.
- Elle peut être ressentie comme une brûlure, des spasmes, une sensation de pression, ou comme des coups de poignard ou de lames de rasoir.
- La douleur irradie dans le bas du ventre, au niveau de l’urètre, ou dans tout le bassin jusqu’à la partie inférieure du dos et l'ensemble de l'abdomen dans certains cas. Elle peut également être ressentie dans l’aine et dans les cuisses.
- Chez la femme, la douleur peut se manifester au niveau du vagin et chez l' homme, au niveau du pénis, des testicules, du scrotum et du périnée ainsi que lors de l’éjaculation.
3) Urgences mictionnelles (urgenturie) :
- incapacité de se retenir sans de violentes douleurs, que seules les mictions (douloureuses aussi) peuvent calmer de façon temporaires.
B) Autres symptômes :
- Relations sexuelles douloureuses (dyspareunie) dans certains cas, voire impossibles.
- Dans près de 50% des cas, les signes urinaires sont associés à un terrain psychologique dépressif.
La CI serait lié à d'autres syndromes douloureux comme le syndrome du côlon irritable, la fibromyalgie et le syndrome de la fatigue chronique.
L’examen clinique gynécologique et neuro-périnéale est en général pauvre et presque toujours normal, à part souvent une douleur à la pression de la vessie au toucher vaginal (expliquant la dyspareunie très fréquente) ou une douleur à la palpation hypogastrique ou urétrale.
EXAMENS COMPLÉMENTAIRES
Le catalogue mictionnel permet d’éliminer un trouble comportemental type polydypsie ou une polyurie.
L’examen cytobactériologique des urines (ECBU) est réalisé afin d’éliminer une infection urinaire.
La cytologie urinaire peut suspecter la présence d’un carcinome excréto-urinaire.
L’échographie vésicale et pelvienne permet d’éliminer une pathologie lithiasique vésicale ou une pathologie des voies génitales.
L’échographie endovaginale est réalisée afin d’éliminer un diverticule urétral suspecté à l’examen clinique.
L’IRM pelvienne permet d’éliminer une endométriose pelvienne en cas de suspicion clinique.
Un examen urodynamique et une cystomanométrie peuvent également être effectués pour évaluer la capacité de la vessie à retenir l’urine et déterminer à quel moment le malade ressent l’urgence d’uriner. Un tuyau souple et fin (cathéter) est inséré dans l’urètre afin de remplir la vessie et d’y mesurer la pression. Un deuxième cathéter est placé dans le rectum pour mesurer la pression dans l’abdomen. En cas de CI, la capacité cystométrique (volumétrique) de la vessie est souvent réduite et les symptômes douloureux apparaissent dès qu’on atteint cette capacité.
La cystoscopie (+/- associée à des biopsies) permet d’observer directement la paroi vésicale grâce à l’introduction d’une fibre optique (cystoscope) par l’urètre. Elle permet :
- de réaliser un test d’hydrodistension. Il est réalisé sous anesthésie générale en position gynécologique, en remplissant la vessie à l’aide d’un cystoscope avec du sérum physiologique situé à 80 cm au-dessus du niveau de la vessie jusqu’à ce que le débit de remplissage cesse par équilibration des pressions. La distension vésicale doit être maintenue pendant deux à cinq minutes. Le test permet d'observer des petits saignements de la taille d’une tête d’épingle (pétéchies sous-muqueux) dans la paroi de la vessie appelées « glomérulations ». Ces micro-hémorragies correspondent à des fissures de la paroi vésicale et sont un signe typique de la cystite interstitielle : elles sont présentes dans 95% des cas. Dans les formes plus sévères, on peut aussi observer une plaie (ulcération) de la paroi de la vessie appelée “ulcère de Hunner”, relativement rare (10% des cas).
- de réaliser des biopsies vésicales à la recherche de modifications histologiques typiques (une inflammation dans la lamina propria, une mastocystose détrusorienne, une présence de tissu de granulation ou une présence de fibrose intrafasciculaire).
- d'éliminer un carcinome in situ vésical.
Certains patients ressentent des douleurs plus importantes suite à l’hydrodistension, 20 à 25% d’entre eux observent une amélioration des symptômes qui peut durer plusieurs mois. L’hydrodistension est donc parfois utilisée régulièrement à des fins thérapeutiques, même si l’organisme finit par s’y habituer et en ressent de moins en moins les bienfaits.
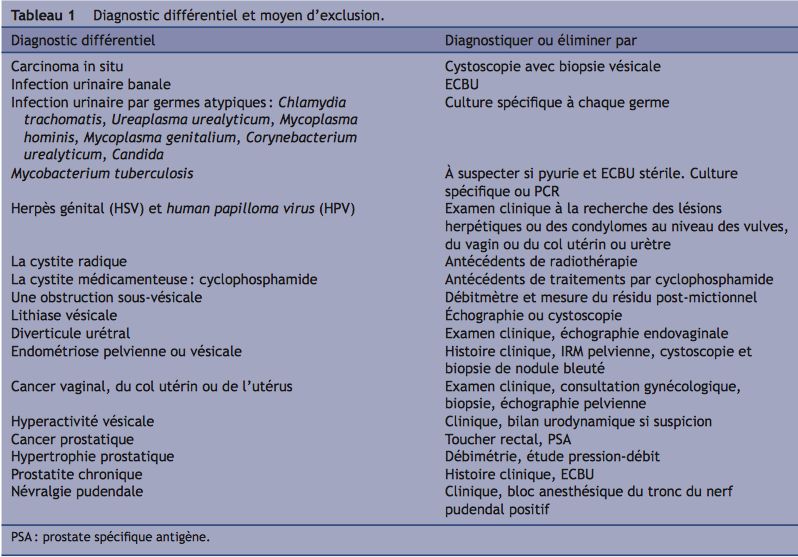
DIAGNOSTICS DIFFÉRENTIELS
- La cystite “classique” correspondant à une inflammation de la vessie causée par des bactéries. la cystite interstitielle n’est pas une infection urinaire bactérienne.
- Les maladies gynécologiques : les infections vaginales (vulvo-vaginite), maladies sexuellement transmissibles (herpès génital, chlamydiae trachomatis, endometriose, atrophie génitale, tumeurs de l'ovaire…
- Les maladies urologiques : lithiases rénales ou vésicaux , l’hyperactivité vésicale ou du détrusor (muscle de la vessie), prostatite chronique chez l’homme, tumeurs de la vessie ou des voies urinaires…
- Les maladies neurologiques : sclerose en plaques…
- cependant, il est important de noter que la cystite interstitielle peut coexister avec une ou plusieurs des affections ci-dessus, ce qui rend le diagnostic encore plus difficile.
COMPLICATIONS
Votre texte ici
PRISE EN CHARGE THÉRAPEUTIQUE
La réponse aux traitements varie en fonction du patient, et il est fréquent d’essayer plusieurs traitements avant d’en trouver un qui soulage. Certaines méthodes ou certains médicaments peuvent avoir des effets bénéfiques assez importants, mais souvent au bout de quelques mois, et malheureusement pendant une période limitée : il est fréquent que le traitement devienne de moins en moins efficace au cours du temps et que les symptômes reviennent.
De plus, il est difficile de dire si une amélioration a été causée par un médicament ou simplement par une rémission spontanée. Par ailleurs, certains médicaments peuvent présenter des effets secondaires plus ou moins graves. Le choix d’un traitement repose donc sur une évaluation précise des besoins du malade par le médecin, qui doit peser le “pour” (amélioration de l’état du patient) et le “contre” (effets indésirables). La prescription de tels médicaments s’accompagne nécessairement d’un suivi attentif avec des examens réguliers permettant de vérifier qu’ils sont bien tolérés par l’organisme.
Il est donc nécessaire de suivre les recommandations de son médecin (respecter les doses et le nombre de prises), et d’avoir confiance en ses choix.
A) Les traitements médicamenteux oraux 1
- Les médicaments vont agir principalement sur la douleur et l’inflammation et directement sur la paroi irritée de la vessie pour la protéger. De façon générale, tous les médicaments antalgiques peuvent être essayés, sachant que chaque malade réagit différemment à chaque médicament.
- Le paracétamol et les antalgiques opiacés, dérivés de la morphine, peuvent être efficaces, seuls ou en association.
- Les anti-inflammatoires non stéroïdiens (ne contenant pas de cortisone), peuvent soulager les douleurs, mais ils sont rarement suffisants et leur effet est peu durable dans le temps.
- Les antidépresseurs tricycliques (et notamment l’amitriptyline chlorhydrate), administrés à des doses inférieures à celles utilisées pour traiter la dépression, ont également une action sur la douleur. Il en va de même pour les antispasmodiques qui atténuent les contractions musculaires douloureuses ou les anticonvulsivants qui agissent sur le système nerveux (gabapentine ou clonazépam).
- Comme l’allergie est l’une des causes probables de la CI, l’administration d’antihistaminiques (hydroxyzine) peut être efficace, surtout chez les patients souffrant conjointement d’allergies avérées.
- Les antiulcéreux, habituellement utilisés pour l’estomac, ont récemment montré une efficacité certaine.
B) Le traitement intravésical par instillation 1
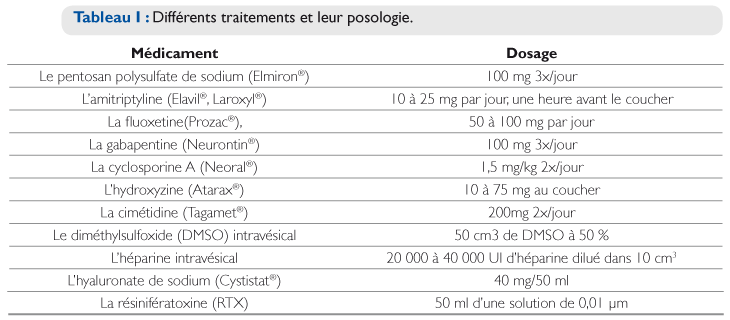
- Le diméthylsulfoxide (DMSO) : le DMSO est un solvant organique possédant une action anti-inflammatoire et analgésique, cependant il entraîne la dissolution du collagène, ce qui peut se traduire à long terme par une fibrose vésicale et expliquer la résistance au traitement après plusieurs cycles de DMSO. Les différentes séries d’études sur le DMSO montrent un effet favorable dans un grand nombre de patients traités avec une faible morbidité. Il peut être utilisé en association avec des corticoïdes et de l’héparine pour augmenter son effet. Le DMSO est éliminé par les alvéoles des poumons et est caractérisé par une odeur spécifique de l’haleine. Il est administré dans une solution à 50 % seul ou en mélange de 50 cm3 de DMSO à 50 % avec 10 ml de bicarbonate de sodium, de corticoïde (40 ml de triamcinolone), de 10 000 U d’héparine et de 80 mg de gentamycine. Le mélange est instillé dans la vessie. Le patient doit retenir le produit pendant 30 à 60 min. Le cycle est hebdomadaire pendant 6 semaines. Un flare up est décrit après la première instillation, avec une amélioration dès la 2e instillation.
- L’héparine : l’héparine est un glycosaminoglycane (GAG) similaire au pentosan polysulfate sodique. Son action est de renforcer le rôle protecteur de la couche de mucine qui couvre l’urothélium vésical. L’instillation vésicale hebdomadaire de 20 000 à 40 000 UI d’héparine diluée dans 10 cm3 de sérum physiologique pendant 4 à 6 semaines est possible. Le schéma idéal d’instillation n’a pas été établi. Ce type d’instillation n’a aucun effet sur la crase. Le produit doit être retenu pendant 30 à 45 minutes. L’utilisation chronique de l’héparine est bénéfique, 4 à 12 mois sont nécessaires avant de noter une amélioration des symptômes.1
- L’hyaluronate de sodium (Cystistat®) : L’hyaluronate de sodium est un dérivé de l’acide hyaluronique. L’acide hyaluronique est un GAG de la couche mucineuse de la vessie. L’administration intravésicale d’hyaluronate de sodium renforce la protection urothéliale de la vessie contre les produits toxiques de l’urine. Le protocole se résume à une instillation hebdomadaire de Cystistat ® (40 mg/50 ml) pendant 4 semaines. Les différentes études montrent que seule une faible proportion de patients souffrant de cystite interstitielle répond au traitement par Cystistat ®, et que pour la majorité d’entre eux, cette réponse est transitoire.
- La chondroïtine sulfate 0.2 % (Uracyst-S®) : la chondroïtine sulfate est une substance présente à l’état naturel dans le revêtement vésical GAG. Ce traitement est censé remédier à la carence de cette substance dans la protection GAG. Son effet est identique à celui de l’hyaluronate de sodium. Une amélioration clinique après instillation de cette substance a été décrite.
- Les neurotoxines vanilloïdes : Les neurotoxines comme la capsaicine et la résinifératoxine (RTX) ont été testées dans la cystite interstitielle. Elles appartiennent au groupe des « vanilloïdes », leur effet dénervant est recherché dans le traitement de l’hyperactivité du détrusor réfractaire. Une étude comparative réalisée en 2005 n’a pas permis de retrouver un bénéfice dans la cystite interstitielle.1 Néanmoins, une étude canadienne a trouvé une amélioration des scores du questionnaire d’Oleary-Sant après instillation de résinifératoxine, mais n’a pas permis de montrer une diminution de la douleur ou de la pollakiurie.1 Le protocole est une instillation hebdomadaire de 50 ml d’une solution de résinifératoxine à 0,01 µm pendant 4 semaines.
- Le nitrate d’argent : le nitrate d’argent exerce un effet caustique, antiseptique et astringent sur la vessie. Il est principalement utilisé dans le cas des patients présentant des hémorragies vésicales. Le nitrate d’argent est souvent administré en association avec une hydrodistension de la vessie. Appliqué à l’époque par Hunner, le traitement intravésical de la CI avec le nitrate d’argent remonte à 1928 et n’est plus recommandé de nos jours. À noter le risque de sténose urétérale par reflux vésico-urétéral.
C) Le traitement intravésical par instillation
- L’hydrodistension : l’hydrodistension vésicale sous anesthésie générale. a un rôle diagnostique et thérapeutique avec 30 à 50 % des patients qui notent une amélioration des symptômes après une hydrodistension. Les symptômes peuvent s’amplifier pendant les 2 à 3 premières semaines suivant le test. Les patients pourvus d’une vessie de petite capacité présentent une meilleure réponse par rapport à ceux avec une grande capacité. La durée d’effet d’une hydrodistension est de 4 à 12 mois. On note une diminution du taux d’amélioration avec le renouvellement des hydrodistensions.
- La toxine botulique (Botox®) : elle compte parmi les plus puissants des poisons naturels. C’est une neurotoxine, produite par une bactérie Gram négative, sporulée, anaérobie stricte, naturellement présente dans l’environnement nommé le Clostridium botulinium. Il existe 7 sérotypes de la toxine botulique. La toxine A est la plus fréquemment utilisée en urologie. Elle bloque la libération de l’acétylcholine et entraîne une paralysie prolongée des organes ainsi dénervés. Plusieurs études rapportent une efficacité de la toxine botulique A pour traiter l’hyperactivité du détrusor résistante aux anticholinergiques. L’efficacité de la TB-A dans la cystite interstitielle reste controversée.1 1 La dose habituelle utilisée varie entre 100 et 200 unités injectées en sous muqueux dans 20 à 30 sites. Il a été décrit une amélioration de la douleur lorsque l’injection de toxine botulique est suivie d’une hydrodistension vésicale 2 semaines après.1
- La neuromodulation sacrée : Elle a été testée chez les patients souffrants de CI avec des résultats encourageants. L’utilisation de la neuromodulation sacrée est réservée aux patients qui ne répondent pas au traitement oral ou intravésical et chez qui une indication de cystectomie reste le seul moyen thérapeutique concevable. L’intervention se fait en deux temps, Le boîtier permanent ne sera implanté qu’en cas d’amélioration clinique notée avec le boîtier externe.
- La cystectomie et la dérivation urinaire : La cystectomie simple reste un choix thérapeutique quand les symptômes sont réfractaires à tous les moyens thérapeutiques conservateurs. La plupart des patients deviennent asymptomatiques après cystectomie simple ou cystectomie supra trigonale avec entérocystoplastie d’agrandissement, mais une minorité de patients continue à présenter des douleurs pelviennes.1 Il est préférable avant de réaliser une cystectomie, d’adresser les patients en consultation de la douleur afin d’évaluer au mieux la localisation de la douleur et de prendre une décision après une concertation pluridisciplinaire.
D) La restriction alimentaire
1) Les facteurs aggravant les symptômes de la CI
- Les facteurs décrits par les patients comme précipitant la douleur de CI sont variés. On note le stress, les rapports sexuels, les vêtements serrés, l’exercice et certains aliments. Le rôle de l’alimentation comme facteur aggravant les symptômes de la CI est considéré comme important.
- De nombreux patients atteints de CI ont remarqué que certains aliments pouvaient exacerber leurs symptômes et que la modification du régime alimentaire suffisait à soulager significativement ces symptômes.
- Cependant, d’un patient à l’autre, ce ne sont pas les mêmes aliments qui aggravent les symptômes. D’autres, en revanche, n’ont constaté qu’une influence minime de cette diète sur leur état clinique.
2) Impact de l’alimentation sur les symptômes
- Pour connaître l’impact qu’exercent les aliments sur les symptômes, il est conseillé de commencer par faire un régime dit « d’élimination » et ne manger que les aliments et boissons figurant sous les rubriques « bien tolérés » et qui conviennent à la plupart des patients. Les patients notent ensuite dans un carnet tout ce que qu’ils mangent et tout ce qu’ils boivent. Après deux semaines, les patients pourront introduire l’un après l’autre des aliments figurant sous les rubriques « à éviter ».
- Si les patients ne ressentent aucune aggravation de leurs symptômes, l’aliment pourra être consommé sans problème. Si au contraire ils ressentent une aggravation des symptômes, il faut éliminer cet aliment de leur régime alimentaire. L’identification des aliments à éliminer est un long processus qui demande de la discipline

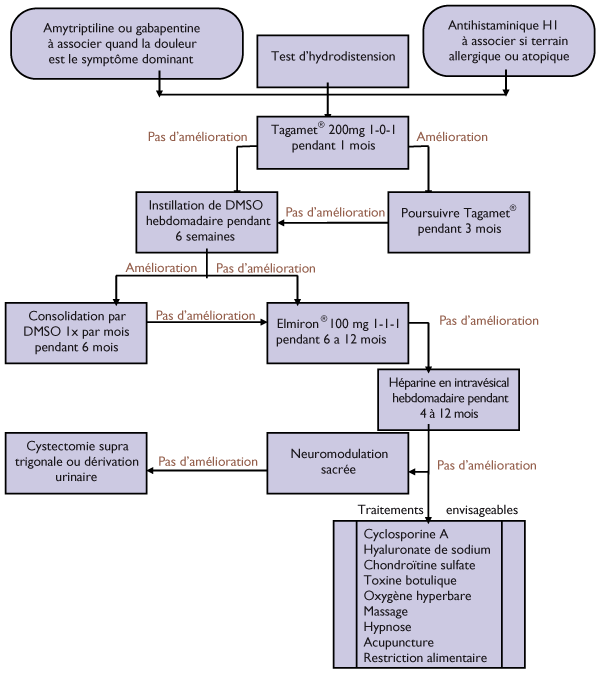
E) Chemin clinique selon l'AFU (association française d'urologie en 2008)
ÉVOLUTION/PRONOSTIC
- La CI se caractérise généralement par des poussées suivies de périodes d'accalmies plus ou moins importantes, évoluant sur un mode chronique. Les symptômes peuvent varier en intensité au cours de la semaine ou même de la journée (crises de quelques heures ou de quelques jours), ou bien être constants pendant des mois ou des années, ou encore s'aggraver progressivement. Même s’ils disparaissent totalement, une rechute est toujours possible, parfois après quelques années de rémission.1
- Par ailleurs, en plus des variations liées au cycle menstruel, les femmes peuvent constater une amélioration ou une exacerbation au cours de la grossesse.
- La sévérité des symptômes et l’évolution de la maladie sont aussi fonction du type de cystite (avec ulcère de Hunner ou non), et de la réponse aux traitements.
PRÉVENTION
Il n'existe actuellement aucun moyen de prévention de la maladie.
SURVEILLANCE
Clinique : la fréquence des mictions, douleurs… Il peut être utile de tenir un calendrier mictionnel (relevé précis du nombre de fois où l’on va aux toilettes).
CAS PARTICULIERS
Votre texte ici
THÉRAPIES FUTURES
- La recherche sur la cystite interstitielle s’est beaucoup développée au cours des deux dernières années. Des groupes de recherche consacrés à cette maladie ont été constitués aux Etats-Unis (au NIDDK pour National Institute of Diabetes and Digestive and Kidney Diseases) et en Europe (ESSIC pour European Society for the Study of Intersitial Cystitis/ Painful Bladder Syndrome). La recherche concerne d’une part la découverte de nouveaux traitements plus efficaces, et d’autre part la compréhension des mécanismes en cause dans la maladie et le contrôle de la régénération du tissu endommagé de la paroi vésicale.
- Une étude récente a par exemple montré l’efficacité d’une combinaison médicamenteuse associant un antidépresseur (Doxepim) à un anti-inflammatoire non stéroïdien (piroxicam).
- La révision des critères diagnostiques par le NIDDK est également en cours.1
