Anaplasmose granulocytaire humaine

INTRODUCTION/GÉNÉRALITÉ
-
Anciennement connue sous le nom d'ehrlichiose granulocytaire humaine.
-
L’anaplasmose granulocytaire humaine est causée par une bactérie : Anaplasma phagocytophilum.
-
Anaplasma phagocytophilum : Bacille à Gram négatif à développement intracellulaire stricte obligés de se multiplier au sein de vacuoles dans le cytoplasme des cellules eucaryotes1 (cible et se multiplie particulièrement les polynucléaires neutrophiles et éosinophiles sous forme de morulae (1,5 à 2,5 µ) et les détruit.1
HISTORIQUE
A) Chez l'animal :
- Chez l’animal, la maladie est décrite dès 1932 en Ecosse chez le mouton et s’appelle alors la « fièvre à tique ». Elle est ensuite décrite au niveau mondial chez différentes espèces animales.3
- En Europe (contrairement aux autres régions du monde) cette infection touche principalement les troupeaux avec de très nombreux cas chez les bovins, les moutons, les chèvres et les chevaux.4 5 En France, l’ehrlichiose granulocytaire animale a été identifiée en 1991 puis en 1998 dans deux troupeaux de vaches laitières des Côtes d’Armor. L’existence de l’ehrlichiose granulocytaire animale est maintenant avérée dans 81 départements français.6
- De nombreux mammifères sauvages sont naturellement infectés par cette bactérie. En Europe de l’Ouest, les chevreuils et les cerfs présentent des prévalences de plus de 85%, ainsi que les campagnols, les mulots (13,4-19,2% et 0,5-4,2% de prévalence respectivement), les musaraignes. En Europe de l’Est et en Asie, on trouve principalement des petits mammifères sauvages infectés notamment les tamias asiatiques. Aux Etats-Unis, les ruminants domestiques semblent peu touchés, par opposition aux animaux sauvages.7 8
B) Chez l’homme :
- Chez l’homme, l’AGH a été décrite pour la première fois en 1994, sur la côte est des États- Unis. Dans ce pays son incidence est actuellement évaluée à 6,1 cas pour un million d'habitants9, elle est en augmentation constante, probablement du fait de la meilleure connaissance de la maladie.
- En Europe, la connaissance de l’AGH est plus récente, les premiers cas ont été décrits en Slovénie, région d'Europe où la prévalence anadémique était la plus élevée en 1997, puis l’infection a été décrite dans de nombreux pays, Suède, Grèce, Espagne, Russie.
- En France, le premier cas humain n’a été décrit qu’en 1999. La présence de l’AGH s'est confirmée avec plusieurs cas rapportés dans l’est du pays10 11 12. Cependant la fréquence réelle de l’infection chez l’homme est probablement sous- évaluée au regard des chiffres élevés de séroprévalence constatés, tant aux États-Unis: 11 à 15 %,13 qu'en Europe : 2 à 28 %.14
ÉPIDÉMIOLOGIE
A) Transmission
- Cette bactérie est vectorisée par un grand nombre d’espèces de tiques et peut infecter de très nombreux mammifères (
Ruminants domestiques, chiens, chevaux, rongeurs, oiseaux)
dont l’homme.1 Cette maladie semble êtreétendue puisqu’elle est décrite au niveau animal et humain aussi bien en Europe, qu’en Asie, aux Etats-Unis ou en Australie.
- La bactérie est transmise par les tiques Ixodes ricinus en Europe, I. persulcatus en Russie et Asie et I. scapularis, I. pacificus et I. spinipalpis aux Etats-Unis.1
- La transmission des tiques à l’hôte se fait généralement en 24h.
B) Prévalence
- Les prévalences de cette bactérie varient d’un pays à l’autre et d’une espèce de tique à l’autre, avec notamment des taux compris entre moins de 1% et 20% chez I. ricinus en Europe de l’Ouest et entre 1,7 et 16,7% chez I. persulcatus en Europe de l’Est.1
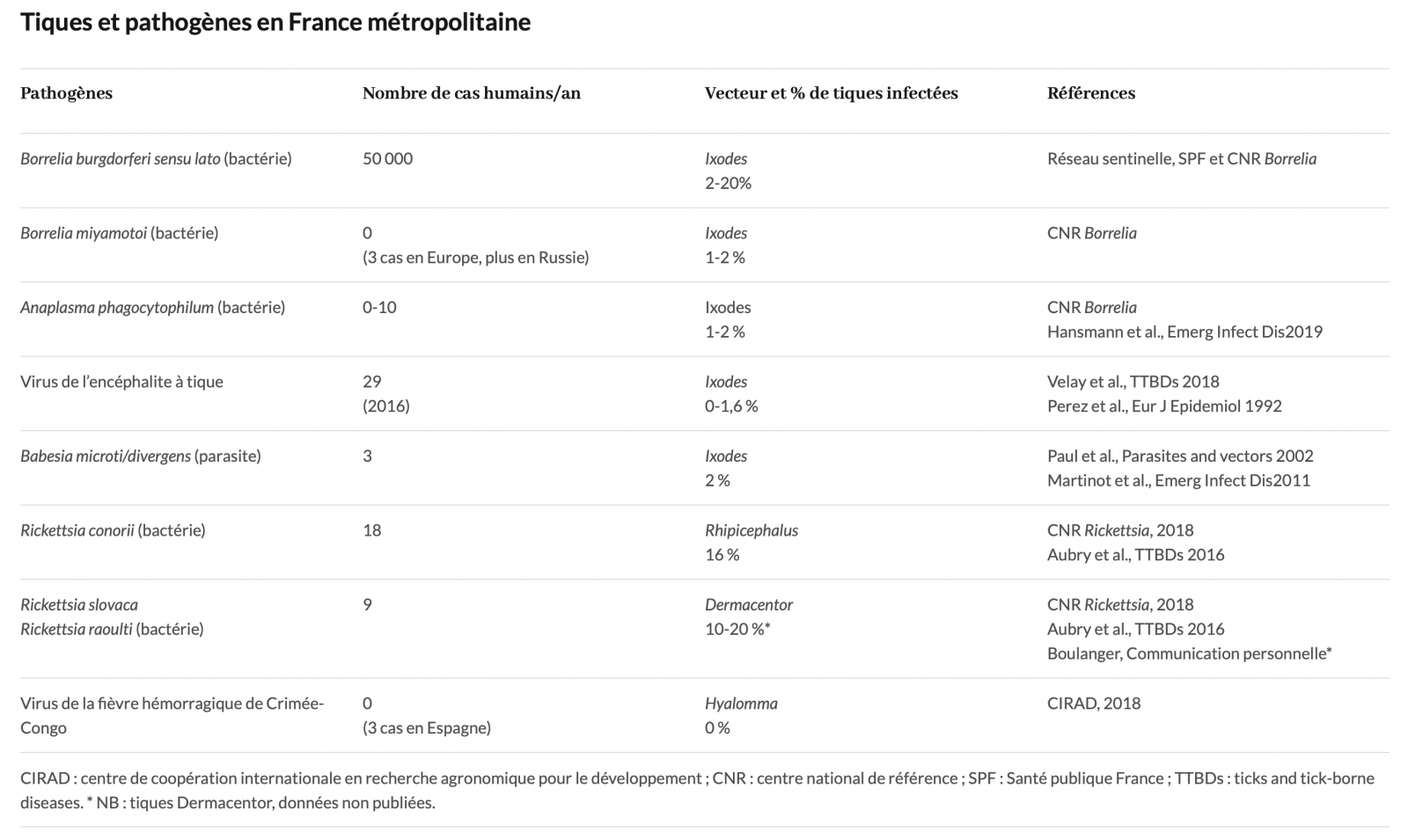
- En France (Alsace), 1 à 2 % des tiques Ixodes sont infectées par cette bactérie.1
C) Incidence
- L’anaplasmose granulocytaire humaine existe en France et est décrite surtout dans le Nord-Est (Alsace). Dans l’étude l’étude Alsa(ce) tique, entre le 1er janvier 2014 et le 31 décembre 2015, 23 signalements d’anaplasmose granulocytaire humaine ont été reçus. Parmi ceux-ci, 3 signalements ont été confirmés biologiquement et répondaient donc à la définition de cas. Un cas a débuté ses signes cliniques en juin 2014, les 2 autres en mai 2015.1
EXAMEN CLINIQUE
-
Le patient peut être asymptomatique.
-
Incubation 7 à 21 jours (médiane de 11 jours) : la maladie s'exprime (une à trois semaines après la morsure de tique).
- Syndrome grippal aigu et non spécifique (avec fièvre dans 98 % des cas), céphalées (81 % des cas), arthro-myalgies (68 % des cas).1
-
Signes plus rares : signes digestifs (nausées, vomissements, diarrhée, douleurs abdominales), éruption cutanée, parfois, des pharyngites, conjonctivites, une toux ou des lymphadénopathies sont observées (25 % des cas), avec aussi un état confusionnel dans environ 25 % des cas.
-
Gravité : Globalement la gravité de l’anaplasmose est faible, La pathologie est généralement spontanément résolutive dans les 30 jours. Il existe cependant des formes sévères possibles notamment chez les patients atteints de néoplasie 1 ou splénectomisé1 : Insuffisance respiratoire, insuffisance rénale, myocardite, coagulation intravasculaire disséminée (CIVD), défaillance multiviscérale, décès possible.
-
Risque de coinfection (Lyme, babésiose, TBE)
EXAMENS COMPLÉMENTAIRES
A) Biologie :
- thrombocytopénie
- et/ou leucopénie
- et/ou augmentation des enzymes hépatiques.
B) Test de confirmation du diagnostic
1) La culture de la bactérie est fastidieuse en raison de son caractère intracellulaire strict et fait donc appel à des laboratoires spécialisés.1
- La mise en évidence d’agrégats bactériens (morulae) présents dans le cytoplasme des neutrophiles sur le frottis sanguin coloré au MGG jusqu’à 4-5 jours après le début des symptômes. Cette technique spécifique manque de sensibilité si le test est réalisé après la première semaine post-infection; du fait de la très faible prévalence d'infection des cellules hôtes, elle nécessite une analyse longue et détaillée du frottis au microscope.1
2) Une PCR A. phagocytophilum en laboratoire spécialisé est actuellement le meilleur outil diagnostique à la phase fébrile de la maladie.1
- La mise en évidence de l’ADN d’Anaplasma par PCR est par contre une technique sensible et précoce, qui permet la détection de l’ADN bactérien dans le sang ou la moelle osseuse jusqu’à 10 jours après le début des symptômes.1
3) La sérologie A. phagocytophilum (immunofluorescence indirecte) permet le diagnostic en cas de séroconversion (multiplication par 4 du taux d’anticorps) souvent à distance de la fièvre.1
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
Votre texte ici
PRISE EN CHARGE THÉRAPEUTIQUE
A) Chez l'humain :
- Chez l’adulte et l'enfant > 8 ans : en cas de suspicion clinique et en attendant les résultats de la sérologie, le traitement de première intention est la doxycycline (200 mg/j chez l’adulte ; 4 mg/kg/j chez l’enfant) pendant 10 jours.
- Chez l’enfant de moins de huit ans ou CI aux cyclines
- La doxycycline est contre-indiquée chez l’enfant de moins de 8 ans et la femme enceinte aux 2e et 3e trimestres en raison d’un risque de coloration des dents de lait de l’enfant né ou à naître.
- On peut utiliser la rifampicine qui a montré une bonne activité dans des observations ponctuelles.1 Rifampicine (si contre-indication à doxycycline), 7 à 10 jours : 300 mg x 2/24H (adulte) ou 10 mg/kg x 2/24H (enfant) (sans dépasser la dose adulte).
B) Chez les animaux
- Le traitement curatif de choix est l’oxytétracycline.
- Un complément thérapeutique symptomatique dont les anti-inflammatoires non stéroïdiens est souvent indiqué.
- La prévention consiste en mesures agri-environnementales (fauchage des limites de pâtures) et zootechniques.1
ÉVOLUTION/PRONOSTIC
Votre texte ici
PRÉVENTION
La prophylaxie de cette maladie à transmission vectorielle repose uniquement sur la prévention des piqûres de tique :
A) Prévention primaire
1) Protection mécanique :
-
La meilleure prévention est le port de vêtements couvrants : pantalon long mis dans les chaussettes (voire guêtres) et chemise à manches longues, de préférence de couleur claire, pour mieux repérer les tiques (grade AE = Accords d'experts).1
2) Protection chimique :
-
Les répulsifs ne sont qu’un complément à la protection mécanique pour des expositions occasionnelles, du fait de l’absence de données de tolérance pour les expositions répétées sur le long terme (grade B). 1
-
Chez les femmes enceintes et les enfants de moins de 24 mois, les répulsifs ne sont pas recommandés en l’absence d’évaluation du rapport bénéfices/risques (grade AE).
-
Les molécules répulsives recommandées sont les suivantes : DEET (seule molécule ayant une autorisation de mise sur le marché, AMM), IR35/35, KBR 3023, PMDRBO (principe actif synthétique de l’eucalyptus citronné).
-
Plusieurs règles sont à respecter : appliquer sur peau découverte (inutile sous les vêtements), respecter l’âge indiqué dans la notice et le rythme des applications, ne pas appliquer en même temps qu’une protection antisolaire (grade B).1
-
Les huiles essentielles, extraites de plantes (lavande, citronnelle, etc.), volatiles, ne sont pas recommandées en raison de leur durée répulsive brève (<1 h) (grade AE).
-
Les bracelets insecticides n’ont pas fait preuve de leur efficacité et ne sont pas recommandés (grade AE).
-
Il est possible d’imprégner les vêtements avec des répulsifs à base de pyréthrine (grade AE). Toutefois, leur tolérance en cas d’utilisation prolongée n’a pas été évaluée et 0,5 % de la dose appliquée sur la peau est absorbée.1
3) Protection vaccinale :
-
Il n’existe pas de vaccin contre l'anaplasmose. Le vaccin contre l’encéphalite à tiques est recommandé avant un séjour en zone rurale ou boisée dans les régions d’endémie, du printemps à l’automne (grade A).
B) Prévention secondaire
-
La prévention secondaire regroupe les mesures recommandées après exposition aux piqûres de tique. Ces mesures s’appliquent même si les mesures de prévention primaire ont été observées (grade AE).
-
Au retour de zones à risque, l’inspection corporelle minutieuse est recommandée (grade AE)1, tout particulièrement les zones chaudes et humides, le cuir chevelu et les oreilles, surtout chez les jeunes enfants. La douche peut être l’occasion de compléter l’inspection corporelle.
-
La taille des tiques est variable selon la stase. La tique grossissant avec son repas sanguin, il est recommandé de répéter l’inspection le lendemain de l’exposition (grade AE).
1) Si une tique est détectée, il est recommandé de (grade AE) :1
-
pratiquer une extraction mécanique avec un crochet à tique ou une pince fine, le plus rapidement possible. Il est déconseillé d’extraire la tique avec les doigts ou d’utiliser des substances telles qu’éther, huile, vernis
-
désinfecter la peau au point de piqûre avec un antiseptique, après retrait de la tique
-
se laver les mains avec du savon
-
réaliser une photographie de la tique et noter la date et le lieu de piqûre : cette photographie pourra être montrée à un médecin ou pharmacien pour identification
-
surveiller la zone au cours des 4 semaines qui suivent afin de détecter un érythème migrant (EM) qui signerait une borréliose de Lyme,1 ou une escarre d’inoculation. Il convient alors de prendre un avis médical en précisant la piqûre récente.
2) Après piqûre de tique, le risque de borréliose de Lyme est < 5 %, même en zone de forte endémie et après fixation prolongée de la tique.1 Par conséquent, après piqûre de tique en France :
-
il n’est pas recommandé de réaliser un sérodiagnostic1 ou un autotest (grade A) ;
-
il n’est pas recommandé de tester la tique extraite pour rechercher des agents infectieux (grade A) ;
-
il n’est pas recommandé d’instaurer une antibiothérapie, quelque soit l’âge de la personne piquée, le nombre de tiques attachées, le temps d’attachement et la stase de la(les) tique(s) retirée(s) (grade B). Cette recommandation s’applique de la même façon pour la population générale, les femmes enceintes, les enfants et les patients immunodéprimés
SURVEILLANCE
Votre texte ici
CAS PARTICULIERS
Votre texte ici
THÉRAPIES FUTURES
Votre texte ici
